St. Petersburg State Technological Institute
(Technische Universiteit)
Afdeling Organische Chemie Faculteit 4
Groep 476.
Cursuswerk
Oxidatie van alkenen
Student ............................................. RYTIN A.I.
Docent .................................... ... St. Petersburg Yu.l.
St. Petersburg
Invoering
1.Epoxidatie (reactie n.a. prilezhev, 1909)
2. Hydroxilisatie
2.1anti -Hydroxylatie
2.2syn -Hydroxylatie
3. Titicultieve splitsing van alkenen
4.OSomolyse
5. Society of Alkenes in de aanwezigheid van palladiumzouten
Conclusie
Lijst van gebruikte bronnen
Invoering
Oxidatie is een van de belangrijkste en gemeenschappelijke transformaties van organische verbindingen.
Onder oxidatie in organische chemie, leidt de processen die leiden tot uitputting van verbindingen met waterstof of verrijking met zijn zuurstof. In dit geval vindt het elektronenmolecuul plaats. Dienovereenkomstig begrijpt het restauratie de scheiding van het organische zuurstofmolecuul of de waterstofbevestiging aan.
Bij oxidatieve reducerende reacties zijn oxidatoren verbindingen met een grote affiniteit voor een elektron (elektrofila) en vermindering van agenten - verbindingen die de neiging hebben om elektronen (nucleofielen) terug te keren. Het gemak van oxidatie van de verbinding neemt toe met de groei van zijn nucleofiliciteit.
Bij het oxideren van organische verbindingen, in de regel, de totale transmissie van elektronen en, dienovereenkomstig, veranderingen in de valentie van koolstofatomen optreden niet. Daarom is het concept van de mate van oxidatie de voorwaardelijke lading van een atoom in het molecuul, berekend, gebaseerd op de veronderstelling dat het molecuul alleen uit ionen bestaat - is slechts voorwaardelijk, formeel karakter.
Bij de bereiding van de vergelijkingen van redox-reacties is het noodzakelijk om het reductiemiddel, het oxidatiemiddel en het aantal toegewijde en ontvangen elektronen te bepalen. In de regel worden de coëfficiënten geselecteerd met behulp van de elektronen-ionsaldo-methode (halfvormingsmethode).
In deze methode, de overgang van elektronen van de ene atomen of ionen naar het andere, rekening houdend met de aard van het medium (zuur, alkalisch of neutraal), waarin de reactie verloopt. Om het aantal zuurstof- en waterstofatomen of watermoleculen en protonen te equialiseren (als het zuurmedium) of watermoleculen en hydroxide-ionen (indien alkaline) worden ingevoerd.
Aldus, bij het schrijven van semitracties van herstel en oxidatie, is het noodzakelijk om door te gaan van de samenstelling van de ionen die in oplossing zijn. Malodissies, slecht oplosbaar of gas dat wordt vrijgegeven in de vorm van gas moeten in moleculaire vorm worden geschreven.
Overweeg als een voorbeeld het proces van ethyleenoxidatie door een verdunde waterige oplossing van kaliumpermanganaat (WAGNER-reactie). In de loop van deze reactie wordt ethyleen geoxideerd tot ethyleenglycol en wordt kaliumpermanganaat gerestaureerd tot mangaandioxide. Bij de dubbele verbinding worden twee hydroxyl toegetreden:
3C 2 H 4 + 2KMNO 4 + 4H 2 O → 3C 2 H 6 O 2 + 2MNO 2 + 2KOH
Semi-Reaction Recovery: MnO 4 ¯ + 2H 2 O + 3 e. → MNO 2 + 4OH ¯ 2Oxidatie Semi-Reactie: C 2H 4 + 2OH - - - 2 e. → C 2H 6 O 2 3
Eindelijk hebben we in ionenformulier:
2MNO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6OH ¯ → 2MNO 2 + 8OH ¯ + 3C 2 H 6 O 2
Nadat u de noodzakelijke bezuinigingen van dergelijke leden uitvoert, schrijf dan de vergelijking in moleculaire vorm:
3C 2 H 4 + 2KMNO 4 + 4H20 \u003d 3C 2 H 6 O 2 + 2MNO 2 + 2KOH.
Kenmerk van sommige oxidatiemiddelen
Zuurstof
Luchtzuurstof wordt veel gebruikt in technologische processen, omdat het de goedkoopste oxidant is. Maar de oxygenatie van luchtzuurstof wordt geassocieerd met de moeilijkheden die verband houden met de controle van het proces, die in verschillende richtingen stroomt. Oxidatie wordt gewoonlijk uitgevoerd bij hoge temperaturen in de aanwezigheid van katalysatoren.
Ozon
Ozon O 3 wordt gebruikt om aldehyden en ketonen te verkrijgen als ze moeilijk op andere manieren te verkrijgen zijn. Meestal wordt ozon gebruikt om de structuur van onverzadigde verbindingen vast te stellen. Ozon wordt verkregen onder de actie van een rustige elektrische ontlading op zuurstof. Een van de aanzienlijke voordelen van ozonisatie, vergeleken met chlorering, is de afwezigheid van gifstoffen na verwerking.
Kaliumpermanganaat
Permanganate Kalium is het meest gebruikte oxidatiemiddel. Het reagens is oplosbaar in water (6,0% bij 20 ° C), evenals in methanol, aceton en azijnzuur. Voor oxidatie, waterige (soms aceton) -oplossingen KMNO 4 in een neutraal, zuur of alkalisch medium worden gebruikt. Bij het uitvoeren van een werkwijze in een neutraal medium, wordt magnesium, aluminium of koolstofdioxide toegevoegd aan de neutralisatie van kaliumvrije hydroxide, wordt toegevoegd aan de reactiemassa. De oxidatiereactie van KMNO 4 in een zuur medium wordt het vaakst uitgevoerd in de aanwezigheid van zwavelzuur. Het alkalische medium in oxidatie creëert de KOH gegenereerd tijdens de reactie, of wordt aanvankelijk toegevoegd aan de reactiemassa. In zwak alkalische en neutrale media, MKNO 4 oxideert door vergelijking:
Kmno 4 +. 3 e. + 2H 2 O \u003d K + + MNO 2 + 4OH ¯
in een zure omgeving:
Kmno 4 +. 5 e. + 8H + \u003d K + + MN 2+ + 4H 2 O
Kaliumpermanganaat wordt gebruikt om 1,2-diolen uit alkenen te verkrijgen, met oxidatie van primaire alcoholen, aldehyden en alkylarens tot carbonzuren, evenals voor oxidatieve splitsing van het koolstofkelet in meerdere obligaties.
In de praktijk wordt meestal vrij groot overschot (meer dan 100%) kmno 4 gebruikt. Dit wordt verklaard door het feit dat onder normale omstandigheden kmno 4 gedeeltelijk ontbinden op mangaandioxide met de release van O 2. Ontbonden geconcentreerde H2S04 dus 4 indien verwarmd in de aanwezigheid van rebuilders met een explosie; Mengsels van kaliumpermanganaat met organische stoffen zijn ook explosieven.
Nadkislot
Perazic en Permaraye Acids worden verkregen door een reactie van 25-90% waterstofperoxide met een geschikt carbonzuur volgens de volgende reactie:
RCOOH + H 2 O 2 \u003d RCOOOH + H 2 O
In het geval van azijnzuur wordt dit evenwicht relatief langzaam ingesteld en voegt u de vorming van pieken te versnellen, gewoonlijk zwavelzuur als een katalysator. Het mierenzuur is op zichzelf sterk genoeg om de snelle instelling van evenwicht te waarborgen.
Penrofunturuces verkregen in een mengsel met trifluorazijnzuurreactie van trifluoracetisch anhydride met 90% waterstofperoxide, een nog sterkere oxidatie. Evenzo kan Perussinezuur worden verkregen uit azijnzuuranhydride en waterstofperoxide.
Vooral populair bedrijf m. -Hlorperbenzoëzuur, omdat het relatief veilig is in omloop, het is redelijk stabiel en kan voor een lange tijd worden opgeslagen.
Oxidatie treedt op vanwege het vrijgegeven zuurstofatoom:
RCOOOH \u003d RCOH + [O]
Nadscisitles worden gebruikt om epoxiden uit alkenen te verkrijgen, evenals lactonen van alicyclische ketonen.
Waterstof peroxide
Waterstofperoxide is een kleurloze vloeistof, gemengd met water, ethanol en diethylether. Een 30% oplossing H202 wordt perhydro genoemd. Het sterk geconcentreerde medicijn kan reageren met organische stoffen met een explosie. Bij het opslaan van ontbinding op zuurstof en water. De weerstand van waterstofperoxide neemt met verdunning toe. Voor oxidatie worden waterige oplossingen van verschillende concentraties gebruikt (van 3 tot 90%) in neutrale, zure of alkalische media.
H 2 O 2 \u003d H 2 O + [O]
De actie van dit reagens op α, P-onbewoonde carbonylverbindingen in het alkalische medium wordt verkregen door geschikte epoxyaldehyden en ketonen, de oxidatie van carbonzuren in het zure medium wordt gesynthetiseerd. Een 30% oplossing H202 in azijnzuur oxideert alkenen in 1,2-diol. Waterstofperoxide wordt gebruikt: om organische en anorganische peroxiden, kiezelsteen en percarbonaat na te verkrijgen; als een oxidatiemiddel in raketbrandstoffen; Bij de bereiding van epoxiden, hydrochinon, pyrocatechin, ethyleenglycol, glycerine, vulkanisatieversnellers van de groep Tyurama et al.; voor whitening oliën, vetten, bont, leer, textielmaterialen, papier; voor het reinigen van germanium- en silicium halfgeleidermaterialen; als een desinfectiemiddel voor verwijdering van huishoudelijk en industrieel afvalwater; in de geneeskunde; als een bron van 2 in onderzeeërs; H202 maakt deel uit van het Fenton-reagens (FE 2 + H202), dat wordt gebruikt als een bron van vrije radicalen in organische synthese.
Ruthenium Tetraxides en Osmia
Tetraoxide OSMIA OSO 4 - Poeder van wit tot lichtgele kleur met t. Pl. 40.6ºС; t. KIP. 131.2ºС. Het wordt verwijderd bij kamertemperatuur, oplosbaar in water (7,47 g van 100 ml bij 25 ° C), CCl4 (250 g van 100 g oplosmiddel bij 20 ° C). In de aanwezigheid van organische verbindingen, smid vanwege de restauratie tot OSO 2.
Ruo 4 is een gouden geel prisma met t. Pl. 25.4ºС, het is merkbaar bereikt bij kamertemperatuur. Matig oplosbaar in water (2,03 g per 100 ml bij 20 ° C), zeer goed oplosbaar in CCL 4. Sterke oxidatie dan OSO 4. Boven 100ºС explodeert. Evenals osmium tetraoxide heeft grote toxiciteit en hoge kosten.
Deze oxidatoren worden gebruikt voor oxidatie van alkenen in α-glycolen in milde omstandigheden.
Dit materiaal kan worden gevouwen in het uiten van zelfstudie, vanwege de grote hoeveelheid informatie, vele nuances, allerlei soorten, maar als. Lees aandachtig!
Waar praten we precies over?
Naast volledige oxidatie (verbranding), voor sommige klassen van organische verbindingen, wordt de reactie van onvolledige oxidatie gekenmerkt, terwijl ze in andere klassen worden.
Er zijn specifieke oxidateurs voor elke klassen: Cuo (voor alcoholen), Cu (OH) 2 en OH (voor aldehyden) en anderen.
Maar er zijn twee klassieke oxidateurs die, zo ja worden uitgedrukt, universeel voor veel klassen.
Dit is kaliumpermanganaat - kmno 4. En een bichromaat (dichromat) van kalium - K2 CR20 7. Deze stoffen zijn sterke oxidatoren als gevolg van mangaan in de mate van oxidatie +7 en chroom tot respectievelijk de mate van oxidatie +6.
Reacties met deze oxidatoren worden vrij vaak gevonden, maar nergens is er geen holistisch leiderschap, volgens welk beginsel producten van dergelijke reacties kies.
In de praktijk zijn er veel factoren die van invloed zijn op de loop van de reactie (temperatuur, medium, concentratie van reagentia, enz.). Vaak blijkt het een mix van producten. Daarom, om het product te voorspellen dat bijna onmogelijk is gevormd.
En voor het examen is het niet geschikt: het is onmogelijk om "misschien of zo, of zo of anderszins of een mengsel van producten te schrijven." Er is een specifiek nodig.
De taakcompilers hebben een specifieke logica geïnvesteerd, waarvan een bepaald principe een bepaald product zou moeten schrijven. Helaas hebben ze niet met iemand delen.
Deze vraag in de meeste voordelen is behoorlijk uitglijden door de partij: twee of drie reacties worden als voorbeeld gegeven.
Ik presenteer in dit artikel, wat kan de resultaten van de onderzoeksanalyse van de taken van het gebruik worden genoemd. De logica en beginselen van de compilatie van oxidatiereacties permanganaat en de dichromaat van solidariteit is vrij hoge nauwkeurigheid (in overeenstemming met de bijv. Normen). Over alles in orde.
Bepaling van oxidatie.
De eerste wanneer we te maken hebben met Redox-reacties, is er altijd een oxidatiemiddel en reductiemiddel.
Oxidator is een mangaan in permanganaat of chroom in een dichromaat, reductiemiddel - atomen in een organische (namelijk koolstofatomen).
Weinig om producten te identificeren, moet de reactie worden geëgaliseerd. Gebruik voor de aanpassing van oudsher de elektronische balansmethode. Om deze methode toe te passen, is het noodzakelijk om de mate van oxidatie van reducerende middelen en oxidateurs voor en na de reactie te bepalen.
Anorganische stoffen van de mate van oxidatie kunnen in staat zijn om 9 te beoordelen:
Maar in het organiseren werden waarschijnlijk in rang 9 niet bepaald. Daarom moet u voordat u de OSR in de organische chemie moet schrijven, moet u leren hoe u de mate van koolstofoxidatie in organische stoffen kunt bepalen. Het gebeurt een beetje anders, anders dan in anorganische chemie.
Koolstof heeft de maximale mate van oxidatie +4, minimum -4. En het kan enige mate van oxidatie van deze opening vertonen: -4, -3, -2, -1, 0, +1, +2, +3, +4.
Eerst moet je onthouden wat de mate van oxidatie is.
De mate van oxidatie is een voorwaardelijke lading die op het atoom ontstaat, wanneer er aangenomen dat elektronische paren volledig worden verschoven naar een meer elektronegatief atoom.
Daarom wordt de mate van oxidatie bepaald door het aantal ontheemde elektronische paren: als het wordt verschoven naar dit atoom, verwerft het een overmatige min (-) lading, indien van een atoom, dan verwerft het een buitensporig plus (+) lading. In principe is dit de hele theorie die u moet weten om de mate van oxidatie van het koolstofatoom te bepalen.
Om de mate van oxidatie van een bepaald koolstofatoom in de verbinding te bepalen, moeten we elke verbinding overwegen en zien welke richting de elektronenstoom wordt verschoven en welke overtollige lading (+ of -) zal voortvloeien uit dit op het koolstofatoom.
We zullen specifieke voorbeelden analyseren:
Koolstof drie banden met waterstof. Koolstof en waterstof - Wie is meer elektronegebrengbaar? Koolstof, het betekent, op deze drie obligaties, het elektronische stel verschuift naar koolstof. Koolstof neemt elke waterstof voor één negatieve lading: het blijkt - 3
Vierde verbinding met chloor. Carbon en chloor - Wie is meer elektronegebrengbaar? Chloor, het betekent, op deze verbinding zal het elektronische stel naar chloor verschuiven. De koolstof verschijnt één positieve lading +1.
Dan moet u gewoon vouwen: -3 + 1 \u003d -2. De mate van oxidatie van dit koolstofatoom: -2.

We definiëren de mate van oxidatie van elk koolstofatoom:

Koolstof heeft drie banden met waterstof. Koolstof en waterstof - Wie is meer elektronegebrengbaar? Koolstof, het betekent, op deze drie obligaties, het elektronische stel verschuift naar koolstof. Koolstof neemt elke waterstof voor één negatieve lading: het blijkt - 3
En een andere verbinding met een andere koolstof. Koolstof en andere koolstof - hun elektronegebillijkheid zijn gelijk, dus de verplaatsing van het elektronische paar komt niet op (de verbinding is niet polair). 

Dit atoom heeft twee banden met één zuurstofatoom en een andere relatie met een ander zuurstofatoom (als onderdeel van de OH-groep). Meer elektronegatieve zuurstofatomen in drie obligaties vertragen het elektronische paar van koolstof, de koolstof verschijnt +3.
De krabbels van de vierde band wordt geassocieerd met een andere koolstof, zoals we al hebben gesproken, op deze verbinding wordt het elektronenpaar niet verschoven.


Twee obligaties, koolstof wordt geassocieerd met waterstofatomen. Koolstof, omdat het meer elektronegative zichzelf op één paar elektronen vertraagde voor elke verbinding met waterstof, verwerft een lading -2.
Dubbele bondage van koolstof is geassocieerd met een zuurstofatoom. Meer elektronegatief zuurstofdensites één elektronisch paar voor elke verbinding. Samen blijkt het koolstof, twee elektronische paren zijn vertraagd. Koolstof verwerft +2 lading.
Samen blijkt het +2 -2 \u003d 0.

We definiëren de mate van oxidatie van dit koolstofatoom:
Drievoudige relatie met meer elektronegatieve stikstof - geeft koolstofheffing +3, vanwege de koolstofbias-koolstof komt niet voor.

Oxidatie permanganaat.
Wat gebeurt er met permanaganaat?
Redox-reactie met permanganaat kan in verschillende media (neutraal, alkalisch, zuur) stromen. En het hangt af van het milieu, zoals het is dat de reactie zal stromen, en welke producten worden gevormd.
Daarom kan het in drie richtingen gaan:

Permanganaat, is een oxidatie, is hersteld. Hier zijn de producten van het herstel:
- Aclest Medium.
Woensdag wordt aangezuurd met zwavelzuur (H2S04). Het mangaan wordt hersteld in de mate van oxidatie +2. En herstelproducten zijn:
KMNO 4 + H2S04 → MNO 4 + K 2 SO 4 + H 2 O
- Alkalische omgeving.
Om een \u200b\u200balkalisch medium te creëren, wordt een vrij geconcentreerde alkali (KOH) toegevoegd. Het mangaan wordt hersteld in de mate van oxidatie +6. Herstelproducten
KMNO 4 + KOH → K 2 MNO 4 + H 2 O
- Neutrale omgeving (en zwak alkalo).
In het neutrale medium, naast permanganaat, gaat water ook de reactie in (die we aan de linkerkant van de vergelijking schrijven), zal het mangaan worden teruggevorderd tot +4 (MNO 2), de herstelproducten zijn:
KMNO 4 + H 2 O → MNO 2 + KOH
En in een licht alkalisch medium (in de aanwezigheid van een oplossing van KOH lage concentratie):
KMNO 4 + KOH → MNO 2 + H 2 O

Wat gebeurt er met biologisch?
Het eerste dat je nodig hebt, is alles begint met alcohol! Dit is de eerste fase van oxidatie. De oxidatie wordt onderworpen aan die koolstof waaraan de hydroxylgroep is bevestigd.
Tijdens de oxidatie verwerft het koolstofatoom "een band met zuurstof. Daarom, wanneer het oxidatiereactieschema is geschreven, is [O] boven de pijl geschreven:
Primaire alcohol Oxiden eerst tot aldehyde, dan aan carbonzuur:

Oxidatie secundaire alcohol In de tweede fase. Omdat koolstof een overgave is, wordt keton gevormd, en niet aldehyde (koolstofatoom in de ketongroep is al fysiek niet in staat om een \u200b\u200bband met een hydroxylgroep te vormen):

Ketonen, tertiaire alcoholen en carbonzuren Volgende niet langer oxideren:

Het proces van oxidatie stapte - terwijl er is waar te oxideren en er is alle omstandigheden hiervoor - de reactie komt eraan. Alles eindigt met het product dat in deze omstandigheden niet oxideert: tertiaire alcohol, keton of zuur.
Het is de moeite waard om het stadium van oxidatie van methanol te vermelden. Bovendien wordt het geoxideerd naar het juiste aldehyde, vervolgens op het juiste zuur:

De eigenaardigheid van dit product (mierenzuur) is dat koolstof in de carboxylgroep geassocieerd is met waterstof, en als u goed kijkt, kunt u zien dat het niets meer is dan Aldehyde Groep:

En de aldehyde-groep, zoals we eerder ontdekt, wordt geoxideerd tot carboxyl:

Herkende de resulterende substantie? Zijn bruto formule H2 CO 3. Dit is coalinezuur dat koolstofdioxide en water desintegreert:
H 2 CO 3 → H 2 O + CO 2
Daarom worden methanol, mieren aldehyde en mierenzuur (ten koste van de aldehyde-groep) geoxideerd tot kooldioxide.
Zachte oxidatie.
Zachte oxidatie is oxidatie zonder sterke verwarming in neutraal of licht alkalisch medium (over de reactie is geschreven 0 ° of 20. °) .
Het is belangrijk om te onthouden dat alcoholen niet worden geoxideerd in milde omstandigheden. Daarom, als ze worden gevormd, dan oxidatie en stops. Welke stoffen zullen toetreden tot de reactie van zachte oxidatie?
- Dubbele binding C \u003d C (WAGNER-reactie) bevatten.
Tegelijkertijd is de π-obligatie verbroken en de bevrijde obligaties "zit" op de hydroxylgroep. Het blijkt een dubbele alcohol:

We schrijven de reactie van de zachte oxidatie van ethyleen (ethen). We schrijven de uitgangsmaterialen en voorspellen de producten. Tegelijkertijd schrijven H 2 O en COH nog niet: ze kunnen zowel in het juiste deel van de vergelijking en aan de linkerkant blijken te zijn. En bepaal onmiddellijk de mate van oxidatie van deelnemende stoffen:

We zullen een elektronisch evenwicht maken (we bedoelen dat het reductiemiddel twee - twee koolstofatomen is, ze worden afzonderlijk geoxideerd):

Selecteer de coëfficiënten:

Uiteindelijk is het noodzakelijk om ontbrekende producten (H20 en KOH) toe te voegen. Het juiste gebrek aan kalium - het betekent dat de alkali gelijk hebben. We zetten de coëfficiënt er voor aan. Aan de linkerkant is er niet genoeg waterstof, het betekent dat het water over is. We plaatsen de coëfficiënt voor het:

We doen hetzelfde met propyleen (propaan):


Passen vaak cycloalkaan. Laat hem je niet in verlegenheid brengen. Dit is een conventionele koolwaterstof met een dubbele binding:

Waar deze dubbele verbinding ook was, zal de oxidatie gelijk worden:

- Met aldehyde-groep.
De aldehyde-groep is meer reactiever (het is gemakkelijker te reageren) dan alcohol. Daarom wordt het aldehyde geoxideerd. Tot zuur:

Overweeg in het voorbeeld van Acetaldehyde (ethanle). We schrijven reagentia en producten en plaatsen de mate van oxidatie. We zullen een evenwicht maken en de coëfficiënten plaatsen vóór het reductiemiddel en het oxidatiemiddel:

In het neutrale medium en de enigszins alkalische koers van de reactie zal iets anders zijn.
In het neutrale medium, zoals we ons herinneren, aan de linkerkant van de vergelijking, schrijven we water, en in het rechterkant van de alkali-vergelijking (gevormd tijdens de reactie):

In dit geval worden het zuur en alkali in één mengsel gevonden. Neutralisatie treedt op.

Ze kunnen niet in de buurt en reageren, zoutvormen:
Tegelijkertijd, als we naar de coëfficiënten in de vergelijking kijken, zullen we begrijpen dat de zuren 3 bidden en alkali 2 bidden. 2 Biddende alkali kan slechts 2 bidzuren neutraliseren (2 biddende zouten worden gevormd). En een mot van zuur blijft. Daarom zal de laatste vergelijking zo zijn:

In het licht alkalische medium is het in overmaat alkali - het wordt toegevoegd aan de reactie, dus al het zuur wordt geneutraliseerd:

Een soortgelijke situatie treedt op wanneer de methanaal wordt geoxideerd. Hij, zoals we onthouden, wordt geoxideerd tot kooldioxide:

Het moet in gedachten worden gebracht dat koolstofoxide (IV) CO 2 zuur is. En zal reageren met alkali. En aangezien het kolenzuur een twee-as is, kan zowel zuur zout en gemiddeld worden gevormd. Het hangt af van de verhouding tussen alkali en koolstofdioxide:
Als de alkali verwijst naar kooldioxide als 2: 1, dan zal er een gemiddeld zout zijn:
Of alkali kan aanzienlijk meer zijn (meer dan twee keer). Als het meer dan twee keer is, blijft het saldo van ALKALIS:
3KOH + CO 2 → K 2 CO 3 + H 2 O + KOH
Dit gebeurt in een alkalisch medium (waar alkali-overmaat, zoals het aan het reactiemengsel wordt toegevoegd aan de reactie) of in een neutrale omgeving wanneer de alkali veel wordt gevormd.
Maar als de alkali verwijst naar kooldioxide als 1: 1, het zal een zuurzout zijn:
KOH + CO 2 → KHCO 3
Als kooldioxide groter is dan u nodig heeft, blijft het overmaat:
KOH + 2CO 2 → KHCO 3 + CO 2
Dit zal in een neutrale omgeving zijn als alkali niet genoeg is gevormd.
We schrijven de bronstoffen, producten, we zullen het evenwicht tussen oxidatie voor het oxidatiemiddel in evenwicht brengen, reductiemiddel en producten die uit hen zijn gevormd:

In het neutrale medium naar rechts vormt u alkali (4kOH):

Nu is het noodzakelijk om te begrijpen wat zal worden gevormd door de interactie van drie mol CO 2 en vier alkali-mol.
3CO 2 + 4KOH → 3KHCO 3 + KOH
KHCO 3 + KOH → K 2 CO 3 + H 2 O
Daarom blijkt het zo:
3CO 2 + 4KOH → 2KHCO 3 + K2 CO 3 + H 2 O
Daarom schrijven we in het juiste deel van de vergelijking twee gebedsgroeven en één mol carbonaat:

En in een zwak alkalische omgeving zijn er geen dergelijke problemen: vanwege het feit dat alkali-overmaat zal worden gevormd door het gemiddelde zout:

Hetzelfde zal zijn bij de oxidatie van het aldehyde van oxaalzuur:

Net als in het vorige voorbeeld wordt een dibasvormig zuur gevormd, en 4 biddende alkali moet op de vergelijking zijn (als 4 bidden permanganaat).
In een neutrale omgeving is opnieuw de hele alkali niet genoeg voor de volledige neutralisatie van het gehele zuur.
Drie biddende alkalis gaat over de vorming van zuur zout, één mol alkali blijft:
3HOOC-COOH + 4KOH → 3KOOOC-COOH + KOH
En deze ene Mol Alkali gaat in interactie met een enkelzuurzout:
KOOC-COOH + KOH → KOOC-COOK + H 2 O
Het blijkt dit als volgt:
3HOOC-COOH + 4KOH → 2KOOC-COOH + KOOC-COOK + H 2 O
Eindvergelijking:

In het zwak alkalische medium wordt het gemiddelde zout gevormd vanwege overtollige alkali:

- Met een drievoudige relatieC.≡ C..
Denk aan wat was met een zachte oxidatie van verbindingen met een dubbele binding? Als je het niet meer herinnert, scroll dan terug - onthoud.
De π-obligatie is storend, de koolstofatomen zijn bevestigd langs de hydroxylgroep. Hier is hetzelfde principe. Het is alleen de moeite waard om te onthouden dat er twee π-obligaties in drievoudige binding zijn. In het begin gebeurt het op de eerste π-communicatie:
Dan op een andere π-communicatie:

De structuur waarin een koolstofatoom twee hydroxylgroepen heeft, extreem onstabiel. Wanneer iets niet in de chemie wordt volgehouden, probeert het "UIT" te vallen ". Water valt uit, zoals dit:

De carbonylgroep wordt verkregen.
Overweeg voorbeelden:
Ethin (acetyleen). Overweeg de stadia van oxidatie van deze stof:

Waterreiniger:




Zoals in het vorige voorbeeld, in een enkel reactiemengsel van zuur en alkali. Neutralisatie vindt plaats - zoutvormen. Zoals te zien is door de coëfficiënt voor permanganaat, zal de alkali 8 mol zijn, dat wil zeggen, het is genoeg voor neutralisatie van zuur. Eindvergelijking:

Overweeg Boudin-2 oxidatie:

Waterreiniger:

Hier wordt zuur niet gevormd, dus het is niet nodig om neutralisatie voor de gek te houden.
Reactie-vergelijking:

Deze verschillen (tussen koolstofoxidatie met de rand en in het midden van de keten) zijn helder aangetoond door het voorbeeld van Pentina:

Waterreiniger:

Het blijkt een substantie van een interessante structuur:

De aldehyde-groep blijft oxideren:
We schrijven de uitgangsmaterialen, producten die de mate van oxidatie bepalen, we zullen evenwichtig, eenvoudige coëfficiënten zijn voordat het oxidatiemiddel en het reductiemiddel:

Alkali moet 2 stapels vormen (aangezien de coëfficiënt vóór permanganaat 2), daarom is het gehele zuur geneutraliseerd:

Harde oxidatie.
Harde oxidatie is oxidatie in zuur, verwijderen Medium. Evenals in neutraal (of laag alkalisch), maar wanneer verwarmd.
In het zure medium ook verwarmd. Maar die harde oxidatie gaat niet in een zuur medium, verwarming is een voorwaarde.
Welke stoffen zullen worden onderworpen aan harde oxidatie? (In eerste instantie zullen we alleen in een zure omgeving analyseren en vervolgens nuances toevoegen die optreden bij het oxideren in een sterk alcoholische en neutrale of zwak alkalische (indien verwarmd) medium).
Met harde oxidatie gaat het proces tot het maximum. Hoewel er geoxideerde - oxidatie gaat.
- Alcoholen. Aldehyden.
Beschouw de oxidatie van ethanol. Het wordt geoxideerd tot het zuur:

Registreer vergelijking. We schrijven de uitgangsmaterialen op, de producten van de OSR, zetten de mate van oxidatie, vormen het saldo. Pas de reactie aan:

Als de reactie wordt uitgevoerd bij het kookpunt van aldehyde wanneer het is om te vormen, zal het verdampen (wegvliegen) van het reactiemengsel, niet zo veel om te oxideren. Hetzelfde effect kan worden bereikt in zeer zachte omstandigheden (zwakke verwarming). In dit geval schrijven we aldehyde als een product:

Overweeg de oxidatie van de secundaire alcohol in het voorbeeld van propanol-2. Zoals reeds vermeld, wordt oxidatie gebroken in de tweede fase (de vorming van carbonylverbinding). Omdat keton wordt gevormd, dat niet is geoxideerd. Reactie-vergelijking:

Oxidatie van aldehyden overwegen bij het onderwerp ethannel. Het wordt ook geoxideerd tot het zuur:

Reactie-vergelijking:

Methanaal en methanol, zoals eerder vermeld, geoxideerd tot kooldioxide:

Methanal:

- Met meerdere obligaties.
In dit geval is de ketting door meerdere communicatie breken. En atomen die zijn gevormd, worden geoxideerd (verwerven een band met zuurstof). Oxisies zo ver mogelijk.
Wanneer de dubbele bonding breekt uit de restjes, worden carbonylverbindingen gevormd (in het onderstaande diagram: van de ene burst - aldehyde, van de andere - keton)

![]()
We zullen de oxidatie van PENTEN-2 analyseren:

Oxidatie van "restjes":

Het blijkt dat twee zuren worden gevormd. We schrijven de uitgangsmaterialen en -producten. We definiëren de mate van oxidatie in atomen, die het veranderen, in evenwicht zijn, gelijk aan de reactie: 
Door het elektronische saldo te vormen, bedoelen we dat het reductiemiddel twee - twee koolstofatomen is, ze worden afzonderlijk geoxideerd:

Zuur zal niet altijd vormen. We zullen bijvoorbeeld oxidatie van 2-methylbuteten analyseren:

Reactie-vergelijking:

Absoluut hetzelfde principe bij het oxideren van verbindingen met een drievoudige binding (alleen oxidatie is onmiddellijk met de vorming van een zuur, zonder een tussenvorming van aldehyde):

Reactie-vergelijking:

Wanneer een meervoudige verbinding precies in het midden bevindt, dan niet twee producten, maar één. Omdat de "restjes" hetzelfde zijn en worden ze geoxideerd naar dezelfde producten:

Reactie-vergelijking:

- Tweemaal kroon zuur.
Er is een zuur dat carboxylgroepen (kronen) met elkaar zijn verbonden:
Dit is sorvalzuur. De twee kronen zijn moeilijk om mee te gaan. Het is zeker stabiel onder normale omstandigheden. Maar vanwege het feit dat in het erin twee carboxylgroepen met elkaar zijn verbonden, is het minder stabiel dan andere carbonzuren.
En daarom kan het met bijzonder harde omgevingen worden geoxideerd. Er is een pauze tussen de "twee kronen":

Reactie-vergelijking:

- Gomologen van benzeen (en hun derivaten).
Benzol zelf wordt niet geoxideerd, vanwege het feit dat de aromaten deze structuur zeer stabiel maken 
Maar zijn homologen worden geoxideerd. Tegelijkertijd is de kettingbrekes, het belangrijkste is om te weten waar precies. Er zijn enkele principes:
- De benzeenring zelf vernietigt niet, en blijft tot nu toe tot het einde, de breuk van communicatie treedt op in de radicaal.
- Oxishes een atoom direct gerelateerd aan de benzeenring. Als, erna, de koolstofketen in de radicaal gaat door - dan is de kloof erna.


We zullen de oxidatie van methylbenzeen analyseren. Er is één koolstofatoom in de radicale oxideert: 
Reactie-vergelijking:

We zullen de oxidatie van isobutylbenzeen analyseren:

Reactie-vergelijking:

We zullen de oxidatie van het tweede butylbenzeen analyseren:

Reactie-vergelijking:

Bij de oxidatie van gomologen van benzeen (en derivaten van homologen) met verschillende radicalen worden twee- drie- en meer grote aromatische zuren gevormd. Oxidatie van 1,2-dimethylbenzeen bijvoorbeeld:

De derivaten van de homologen van benzeen (waarin de benzeenring geen koolwaterstofradicalen is), oxideren hetzelfde. Een andere functionele groep interfereert niet met de benzeenring:


Subtotaal. Algoritme "Hoe registreren de respons van harde oxidatie permanganaat in een zure omgeving":
- Registreer uitgangsmaterialen (Organisch + kmno 4 + H2S04).
- Schrijf organische oxidatieproducten (verbindingen die alcohol, aldehyde-groepen, meerdere obligaties bevatten, evenals benzeen homologen).
- Schrijf het PermanDanate Recovery-product (MNO 4 + K 2 SO 4 + H20).
- Bepaal de mate van oxidatie van de deelnemers aan de OSR. Balans. Slip de coëfficiënten van het oxidatiemiddel en het reductiemiddel, evenals de stoffen die van hen zijn gevormd.
- Dan wordt het aanbevolen om te berekenen hoeveel sulfaat-anionen in het rechterkant van de vergelijking, in overeenstemming met dit de coëfficiënt voor het zwavelzuur aan de linkerkant plaatsen.
- Doe aan het einde de coëfficiënt vóór water.
Harde oxidatie in een sterk alkalig medium en neutraal of zwak alkalisch (indien verwarmd).
Deze reacties zijn veel minder vaak. Er kan worden gezegd dat dergelijke reacties exotisch zijn. En zoals het moet worden gemaakt door exotische reacties, waren deze het meest tegenstrijdig.
Harde oxidatie Het is stijf in Afrika, dus het organische wordt op dezelfde manier geoxideerd als in een zure omgeving.
Afzonderlijk zullen we de reactie voor elke klasse niet demonteren, aangezien het algemene principe al eerder is geschetst. We zullen alleen de nuances analyseren.
Elimineer omgeving :
In een sterk algen wordt permanganaat gerestaureerd tot de mate van oxidatie +6 (kaliummantanaat):
KMNO 4 + KOH → K 2 MNO 4.
In een sterke alkali-alkali is er altijd een overschot, dus volledige neutralisatie zal worden gehouden: als kooldioxide wordt gevormd - er zal een carbonaat zijn als zuur wordt gevormd - er zal een zout zijn (als het zuur het middelste zout is).
Bijvoorbeeld de oxidatie van prope:

Ethylbenzeen Oxidatie:

Label of neutraal medium wanneer verwarmd :
Het moet ook rekening houden met de mogelijkheid van neutralisatie.
Als oxidatiestromen in een neutraal medium en een zure verbinding (zuur of kooldioxide) wordt gevormd, zal de resulterende alcohol deze zuurverbinding neutraliseren. Maar niet altijd alkali is genoeg voor volledige neutralisatie van zuur.
Wanneer de aldehyden worden geoxideerd, bijvoorbeeld, is het niet genoeg (oxidatie zal op dezelfde manier doorgaan als bij milde omstandigheden - de temperatuur versnelt eenvoudig de reactie). Daarom worden zout en zuur (de resterende grof gesprek in overmaat) gevormd.
We bespraken het als ze de zachte oxidatie van aldehyden demonteren.
Daarom, als het zuur wordt gevormd in de neutrale omgeving, moet u zorgvuldig kijken of het voldoende is voor de neutralisatie van het gehele zuur. Speciale aandacht moet worden besteed aan de neutralisatie van polypische zuren.
In een licht alkalisch medium worden alleen gemiddelde zouten gevormd vanwege voldoende alkali, als alkali-overmaat.
In de regel is alkali tijdens oxidatie in een neutraal medium genoeg. En de reactievergelijking die neutraal is dat in het zwak alkalische medium hetzelfde zal zijn.
We zullen bijvoorbeeld de oxidatie van ethylbenzeen analyseren:


Alkali is genoeg voor de volledige neutralisatie van de zure verbindingen, zelfs overtollige overblijfselen:

3 Bidden Alkali wordt geconsumeerd - 1 overblijfselen.
Eindvergelijking:

Deze reactie in een neutraal en laag alkalisch medium zal eveneens gaan (er is geen alkali in het low-alkalische medium, maar dit betekent niet dat het niet is, het gaat gewoon niet de reactie in).
Redox-reacties met betrekking tot de dichromaat (bichromaat) van kalium.
Bichromat heeft geen grote verscheidenheid aan organische oxidatiereacties bij het examen.
Oxidatie door Bichromate wordt meestal alleen uitgevoerd in een zure omgeving. Met dit chroom wordt gerestaureerd naar +3. Herstelproducten:
Oxidatie zal moeilijk zijn. De reactie lijkt erg op de oxidatie van permanganaat. Dezelfde stoffen zullen oxideren dat ze worden geoxideerd door permanganaat in een zure omgeving, dezelfde producten zullen worden gevormd.
We zullen enkele reacties analyseren.
Overweeg de oxidatie van alcohol. Als we oxidatie op het kookpunt van Aldehyde uitvoeren, zal het hun reactiemengsel hebben, zonder blootgesteld aan oxidatie:

Anders kan de alcohol direct worden geoxideerd naar het zuur.
Aldehyde, verkregen tijdens de vorige reactie, kan worden "betrapt" en maakt het geoxideerd tot zuur:

Oxidatie van cyclohexanol. Cyclohexanol is een secundaire alcohol, dus Keton is gevormd:

Als het moeilijk is om de mate van oxidatie van koolstofatomen door een dergelijke formule te bepalen, kan op het ontwerp worden geverfd:

Reactie-vergelijking:

Overweeg de oxidatie van Cyclopenten.
De dubbele obligatie breekt (de cyclus wordt geopend), de atomen die het vormen, worden tot het maximum geoxideerd (in dit geval, naar de carboxylgroep):


Sommige kenmerken van oxidatie in het examen, met wie we het niet helemaal eens zijn.
Die "regels", principes en reacties die in deze sectie zullen worden besproken, beschouwen we niet helemaal correct. Ze spreken niet alleen de echte stand van zaken (chemie als wetenschap), maar ook interne logica van het schoolprogramma en het examen in het bijzonder.
Maar toch worden we gedwongen om dit materiaal precies in de vorm te geven die het examen vereist.
Het gaat over harde oxidatie.
Denk eraan hoe gomologen worden geoxideerd en hun uitgesproken in harde omstandigheden? Radicalen zijn volledig gebroken - carboxylgroepen worden gevormd. De restjes worden blootgesteld aan oxidatie al "onafhankelijk":

Dus als een hydroxylgroep plotseling een radicaal of een meervoudige communicatie is, moet u vergeten dat er een benzeenring is. De reactie gaat alleen op deze functionele groep (of meerdere communicatie).
Functionele groep en meervoudige communicatie-goster dan benzeenring.

We zullen de oxidatie van elke stof analyseren:
Eerste substantie:

Je moet niet letten op het feit dat er een benzeenring is. Vanuit het oogpunt van het gebruik is slechts secundaire alcohol. Secundaire alcoholen worden geoxideerd naar ketonen en ketonen zijn niet geoxideerd:

Laat deze stof worden geoxideerd door Bichromate:

Tweede substantie:

Deze stof wordt geoxideerd, eenvoudigweg als een dubbel verbonden verbinding (we letten niet op de benzeenring):

Laat het worden geoxideerd in neutraal permanganaat wanneer verwarmd:

Gevormde alkali genoeg voor volledige neutralisatie van koolstofdioxide:
2KOH + CO 2 → K 2 CO 3 + H 2 O
Totale vergelijking:

Oxidatie van de derde substantie:

Stel dat oxidatie kalium permanganaat zal lekken in een zure omgeving:

Oxidatie van de vierde zaak:

Het wordt geoxideerd in het slimme medium. De reactie-vergelijking zal zijn:

Nou, ten slotte is het zo geoxideerd door Vinylbenzeen:

En het wordt geoxideerd tot benzoëzuur, het is noodzakelijk om in gedachten te houden dat volgens de logica van het examen zo geoxideerd is omdat het een derivaat is van benzeen. En omdat het een dubbele binding bevat.
Conclusie.
Het is alles wat u moet weten over Redox-reacties met permanganaat en bichromaat in een organisch.
Wees niet verrast als, sommige momenten uiteengezet in dit artikel, je hoort voor de eerste keer. Zoals al vermeld, is dit onderwerp zeer uitgebreid en tegenstrijdig. En ondanks dit, om een \u200b\u200bof andere reden, betaalt ze extreem weinig aandacht.
Zoals je misschien overtuigd bent, leggen twee-drie reacties niet alle patronen van deze reacties uit. Hier heb je een geïntegreerde aanpak en een gedetailleerde uitleg van alle momenten nodig. Helaas in de leerboeken en op de internetbronnen, is het onderwerp niet volledig bekendgemaakt, of helemaal niet bekendgemaakt.
Ik probeerde deze gebreken en tekortkomingen te elimineren en overweegt dit onderwerp volledig en niet gedeeltelijk. Ik hoop dat ik het heb bewezen.
Bedankt voor je aandacht, jullie zijn allemaal goed! Successen in de ontwikkeling van chemische wetenschappen en passerende examens!
4.5. Oxidatie van alkenen
Alkeenoxidatiereacties zijn raadzaam om in twee grote groepen te delen: reacties waarin het koolstofkelet en de reactie van de oxidatieve vernietiging van het koolstofskelet van het dubbele bindmolecuul wordt bewaard. De eerste groep reacties omvat epoxidatie, evenals hydroxylering, wat resulteert in de vorming van vicinale diolen (glycolen). In het geval van cyclische alkenen tijdens hydroxylering, wordt vicinal gevormd trance- of cis-Diolen. Een andere groep omvat ozonolyse en een reactie van een uitputtende oxidatie van alkenen, wat leidt tot de vorming van verschillende soorten carbonylverbindingen en carbonzuren.
4.5.A. De oxidatiereacties van alkenen met het handhaven van een koolstofskelet
1. Epoxidatie (reactie n.a. prilezhev, 1909 g)
Aciclische en cyclische alks bij het interieren met peracid (suprachlotes) RCOOOH in een niet-polaire, onverschillige medium-vormepoxiden (oxirans), dus de reactie zelf wordt de epoxidatiereactie genoemd.
Volgens de moderne nomenclatuur Jupak - een drie-ledige cyclus met één zuurstofatoom wordt oxira genoemd.
Epoxidatie van alkenen moet worden beschouwd als een synchroon, gecoördineerd proces waarbij ionische tussenproducten van het type hydroxylkation niet betrokken zijn. Met andere woorden, de epoxidatie van alkenen is een proces syn- Troubleto één zuurstofatoom voor dubbele communicatie met het volledige behoud van de substituentconfiguratie bij dubbele binding.
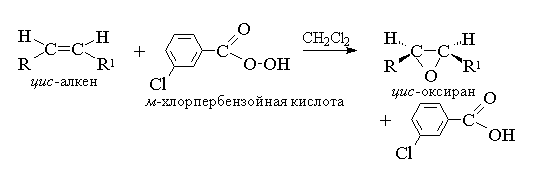

Voor epoxidatie werd een mechanisme voorgesteld voor overeengekomen processen.

T. K. Double-binding aanvalatoom van zuurstofzuurstof is even gelijk aan beide zijden van het dubbele bindvlak, gevormde oxyranes zijn ook meso- vormen of mengsels van enantiomeren. De volgende peculaten worden gebruikt als epoxidatiemiddelen: PEBENZOIC, m.-Hlorperbenzoic, Monoperfthal, Perussum, Trifluorperuce en Permaneuury. De Perkyschotes van de aromatische reeks worden gebruikt in de vorm van individuele reagentia, terwijl Perkisles van alifatische rijen - CH3C03H, CF3C03H en NSO 3 N niet afzonderlijk worden geïsoleerd, maar wordt gebruikt na hun vorming tijdens de interactie van 30% of 90% waterstofperoxide en geschikt carbonzuur. Perbenzoic I. m.-Hlorperbenzoëzuur wordt verkregen door oxidatie, respectievelijk, benzoïs en m.-Hoorbenzoëzuren met 70% waterstofperoxide in methaansulfonzuuroplossing of van chloridehydrydriden van deze zuren en waterstofperoxide.


Monoperftaalzuur wordt verkregen door een soortgelijke werkwijze van ftaalzuuranhydride en 30% waterstofperoxide.

Aanvankelijk werden PEBENZOIC of monoperctische zuren gebruikt om oxiranes (epoxiden) te verkrijgen:

Momenteel, voor epoxidatie, meestal gebruik m.-Hlorperbenzoëzuur. In tegenstelling tot andere Perksloot is het stabiel wanneer het gedurende een lange tijd wordt opgeslagen (tot 1 jaar) en is absoluut veilig bij het contacteren. Oxyranten verkregen tijdens de oxidatie van acyclische en cyclische alkenen m.-Herperbenzoëzuur in methyleenchloride-oplossing, chloroform of dioxaan, meestal vrij hoog.



Perkyschotes worden vaak direct gegenereerd in het reactiemengsel van 90% waterstofperoxide en carbonzuur in methyleenchloride.


Dubbel-obligatie alkenen geassocieerd met een carbonylgroep of een andere acceptorubstituent, laagactieve en voor hun oxidatie is het beter om sterkere oxidanten te gebruiken, zoals trifluoroprucuszuur verkregen uit trifluorazijnzuuranhydride en 90% waterstofperoxide in methyleenchloride. Het eenvoudigste oxiran-ethyleenoxide wordt verkregen in de industrie door oxidatie van ethyleen door zuurstof in aanwezigheid van zilver, als een katalysator.

2. anti-Hydroxylatie
De drie-ledige ring van oxyranes wordt gemakkelijk onthuld onder de werking van een breed scala aan nucleofiele reagentia. Deze reacties worden in detail besproken in het gedeelte gewijd aan acyclische en cyclische eenvoudige ether. Alleen Oxyraneshydrolyse zal hier worden overwogen. De hydrolyse van oxyranes wordt gekatalyseerd door zowel zuren als basen. In beide gevallen worden vicinale diolen gevormd, d.w.z. glycolen. In de zuurkatalyse in de eerste fase wordt het zuurstofzuurstofatoom geprotoneerd aan de vorming van een cyclische oxonium-kation, die wordt bekendgemaakt als gevolg van een nucleofiele aanval van watermolecuul:

De belangrijkste fase in de openbaarmaking van de ring, die de snelheid van het hele proces bepaalt, is de nucleofiele aanval met water op de protoneerde vorm van Oxiran. Vanuit het oogpunt van het mechanisme is dit proces vergelijkbaar met de openbaarmaking van een broomion-ion met een nucleofiele aanval van een bromide-ion of een ander nucleofiel middel. Uit deze posities zouden stereochemische resultaten onderwijs moeten zijn trance- glycolen bij het splitsen van cyclische epoxiden. Inderdaad, met de zuurgekatalyseerde hydrolyse van cyclohexenoxide of cyclopenoxide uitsluitend gevormd trance-1,2-diol.

Zo komt het tweestapsproces van epoxidatie van alkeen gevolgd door zuurhydrolyse van epoxide-totaal overeen met de reactie anti- hydroxilisatie van alkenen.
Beide stadia anti- Hydroxylining van alkenen kan worden gecombineerd als alkeen wordt behandeld met waterig 30-70% waterstofperoxide in mier of trifluorazijnzuur. Beide zuren zijn sterk genoeg om de openbaarmaking van de OxiRane-cyclus te veroorzaken.

De openbaarmaking van de oxyrande ring gekatalyseerd door de basis leidt ook tot de vorming van cyclisch trance-Glikoli.

Bijgevolg is het tweetrapsproces van epoxidatie van alkenen met daaropvolgende alkalische hydrolyse van epoxiden ook een reactie anti- hydroxilisatie van alkenen.
3. syn-Hydroxylatie
Sommige zouten en oxiden van overgangsmetalen in de hoogste mate van oxidatie zijn effectieve reagentia. syn- hydroxilisatie van de dubbele binding van alkenet wanneer beide hydroxylgroepen zijn verbonden aan dezelfde zijde van de dubbele verbinding. Oxidatie van alkenen permanganaat kalium - een van de oudste methoden syn- Hydroxilisatie van dubbele communicatie - blijft op grote schaal worden gebruikt, ondanks de beperkingen die kenmerkend zijn. Cis-1.2-cyclohexaandiol werd voor het eerst ontvangen door V.V. Markovnikov in 1878 door de hydroxylering van cyclohexen met waterige oplossing van kaliumpermanganaat bij 0 0 C.

Deze methode in de toekomst is ontwikkeld in de werken van de Russische wetenschapper E.E. Wagner, daarom syn- hydroxilisatie van alkenen in het kader van de werking van een waterige oplossing van permanganaatkalium wordt de Wagner-reactie genoemd. Kaliumpermanganaat is een sterk oxidatiemiddel dat niet alleen de dubbele binding kan hydroxy kan hydroxy, maar ook de vorming-vicinale diol splitsen. Om verdere splitsing van glycolen te voorkomen, is het noodzakelijk om de reactieomstandigheden voorzichtig te volgen. De uitgangen van glycolen tegelijkertijd zijn meestal klein (30-60%). De beste resultaten worden bereikt in hydroxylering van alkenen in een zwak alkalisch medium (pH ~ 8 9) bij 0-5 0 met een verdund met 1% waterige oplossing van KMNO 4.


Aanvankelijk wordt tijdens de oxidatie van alkenen permanganaat kalium, een cyclische ether van mangaanzuur gevormd, dat onmiddellijk wordt gehydrolyseerd aan de vicinale diola.

De cyclische ester van mangaanzuur als tussenproduct was niet geïsoleerd, maar de vorming volgt uit experimenten met gelabeld 18 op kaliumpermanganaat: zowel zuurstofatomen in glycol zijn geëtiketteerd wanneer de alkina oxidatie KMN 18 O 4 is. Dit betekent dat beide zuurstofatomen van het oxidatiemiddel gaan, en niet van het oplosmiddel - water, dat in het goede is volgens het voorgestelde mechanisme.
Een andere methode syn- Hydroxilisatie van alkenen onder de werking van OSMIA-oxide (VIII) OSO 4 werd voorgesteld door R. Kryga in 1936. Osmia Tetraoxide is een kleurloos, vliegen, kristallijn, goed oplosbaar op lucht, dioxaan, pyridine en andere organische oplosmiddelen. Wanneer het osmiumtetraoxide samenwerkt met alkanen in de lucht of dioxaan, wordt een zwart precipitaat van osmumzuurcyclische ester gevormd - OSMAT, die eenvoudig afzonderlijk kan worden geïsoleerd. De toevoeging van OSO 4 aan dubbele obligaties is merkbaar versneld in de oplossing in pyridine. De ontbinding van osmastes aan de vicinale glycolen wordt bereikt door de werking van waterig natriumhydrosulfiet of waterstofsulfide.

Productuitgangen syn-Hyndroxylering van alkenen in deze methode is aanzienlijk hoger dan bij het gebruik van permanganaat als een oxidatiemiddel. Een belangrijk voordeel van de KRIG-methode is de afwezigheid van oxidatieve splitsingsproducten van alkenenkarakteristiek van permanganaatoxidatie.


Osmia Tetraoxide is een zeer duur en moeilijk te bereiken reagens, en het is giftig. Daarom wordt OSMIA-oxide (VIII) gebruikt in de synthese van kleine hoeveelheden moeilijke stoffen om de hoogste uitvoer van het diol te verkrijgen. Om te vereenvoudigen syn-Hyndroxylering van alkenen onder de actie van OSO 4 is ontwikkeld door een techniek waarmee we alleen de katalytische hoeveelheden van dit reagens kunnen gebruiken. Alkeenhydroxylering wordt uitgevoerd met behulp van waterstofperoxide in de aanwezigheid van OSO 4, bijvoorbeeld:

In de conclusie van deze sectie geven we stereochemische betrekkingen tussen alkeen cis- of trance- Configuratie en configuratie van het gevormde vicinale diol, dat kan zijn cis- of trance-Zeter, erytro- of treo-Voedsel meso- of D, L.-Form, afhankelijk van de afgevaardigden in Alken:

Vergelijkbare stereochemische relaties worden waargenomen in andere reacties syn- of anti- Tijdens het veelvoud van de toevoer van waterstof, halogeneraten, water, halogeen, boriumhydriden en andere reagentia.
Compilatie van vergelijkingen van redox-reacties met organische stoffen
IN Communicatie met de invoering als de enige vorm van de definitieve certificering van middelbare school afgestudeerden van een enkel staatsexamen (gebruik) en de overgang van de middelbare school voor profieltraining wordt steeds relevanter voor de voorbereiding van middelbare scholieren om de meest "dure te vervullen" "Taken van deel" met "Test van het examen in de chemie. Ondanks het feit dat de vijf taken van het onderdeel "C" worden beschouwd als verschillend: de chemische eigenschappen van anorganische stoffen, de ketens van de omzetting van organische verbindingen, de berekende taken - ze zijn op de een of andere manier op de een of andere manier geassocieerd Redox-reacties (OSR). Als de belangrijkste kennis van de theorie van de OSR wordt geleerd, kunt u de eerste en tweede taken volledig uitvoeren, en de derde is gedeeltelijk. Naar onze mening is een aanzienlijk deel van het succes bij het uitvoeren van een deel "C" precies hierin. Ervaring toont aan dat als, als, het bestuderen van anorganische chemie, studenten goed worden geactiveerd met de taken van het schrijven van de OSR-vergelijkingen, de vergelijkbare taken voor organische chemie hen grote moeilijkheden veroorzaken. Daarom proberen we in de studie van de hele loop van de organische chemie in profielklassen, de vaardigheden van de compilatie van de OPR-vergelijkingen in middelbare scholieren te vormen.
Bij het bestuderen van de vergelijkende kenmerken van anorganische en organische verbindingen, introduceren we studenten met behulp van de mate van oxidatie (C.O.) (in organische chemie, eerste van alle koolstof) en methoden voor de vastberadenheid:
1) Berekening van medium S.O. koolstof in het organische materiaalmolecuul;
2) Definitie van S.O. Elk koolstofatoom.
We specificeren in welke gevallen het is beter om een \u200b\u200bof andere manier te gebruiken.
Het artikel is gepubliceerd met de ondersteuning van het bedrijf "Geo-engineering", vertegenwoordigt de producten op de markt onder het merk "Profkwresla". Reikwijdte van het bedrijf - productie, verkoop en installatie van stoelen en stoelen voor verschillende hallen. Met de hoge professionaliteit van het personeel en hun eigen productiefaciliteiten kunt u projecten snel en efficiënt implementeren van enige mate van complexiteit. Alle producten onder het merk "Profkwresla", zijn een tonatrale stoelen, stoelen voor wachtkamers of stoelen voor onderwijsinstellingen, onderscheidend modern en ergonomisch ontwerp, evenals een hoge slijtvastheid, kracht en comfort. Van het enorme assortiment producten in de catalogus op de site Profkresla.ru, kunt u altijd kiezen voor de modellen die het beste relevant zijn voor zakelijke stijl die in uw bedrijf zijn aangenomen. Als u nog steeds problemen ondervindt met de keuze, zijn de experts van het bedrijf altijd klaar om advies te geven, om het model te bepalen, waarna het is om het project te bereiden, ter plaatse om alle benodigde metingen en installatie te produceren.
P De studie van het onderwerp "Alkana" toont aan dat de processen van oxidatie, verbranding, halogenering, nitratie, uitdroging, ontbinding betrekking hebben op redox-processen. Bij het schrijven van de vergelijkingen van verbrandingsreacties en ontbinding van organische stoffen, is het beter om de gemiddelde waarde van C.O te gebruiken. Koolstof. Bijvoorbeeld:
We vestigen de aandacht op de eerste helft van het elektronische saldo: bij het koolstofatoom in de fractionele waarde van S.O. De noemer is 4, dus de berekening van elektronentransmissie wordt uitgevoerd volgens deze coëfficiënt.
In andere gevallen bepalen we bij het bestuderen van het onderwerp "Alkans" de waarden van S.O. Elk koolstofatoom in de verbinding, die de aandacht van studenten op de hoogte is van de vervanging van waterstofatomen in het primaire, secundaire, tertiaire koolstofatomen:


Aldus samenvatten we studenten in de conclusie dat het vervangingsproces in tertiaire, dan in secundair, en, laatste keer - in primaire koolstofatomen.
P De studie van het onderwerp "Alkenes" beschouw oxidatieprocessen afhankelijk van de structuur van alkenet en het reactiemedium.
Wanneer de alks worden geoxideerd door de geconcentreerde oplossing van kaliumpermanganaat KMNO 4 in een zuur medium (stijve oxidatie), treedt een pauze voor - en -cons met de vorming van carbonzuren, ketonen en koolstofoxide (IV). Deze reactie wordt gebruikt om de positie van de dubbele binding te bepalen.
Als de dubbele binding aan het einde van het molecuul is (bijvoorbeeld bij Bouthena-1), is een van de oxidatieproducten mierenzuur, gemakkelijk geoxideerd tot koolstofdioxide en water:

We benadrukken dat indien in het alkinemolecuul, het koolstofatoom bij een dubbele binding twee koolstofubstituenten omvat (bijvoorbeeld in een 2-methylbutene-2-molecuul), dan wanneer het oxidatie is, optreedt de ketonvorming, omdat de conversie Van een dergelijk atoom in een atoom van de carboxylgroep is onmogelijk zonder C-C-communicatie, relatief stabiel onder deze omstandigheden te breken:

We specificeren dat als het alkin-molecuul symmetrisch is en de dubbele binding in het midden van het molecuul bevindt, slechts één zuur wordt gevormd tijdens oxidatie:

We informeren dat het kenmerk van de oxidatie van alkenen waarin koolstofatomen bij een dubbele binding twee koolstofradicalen omvat, de vorming van twee ketonen is:


Gezien de oxidatie van alkenen in neutrale of zwak alkalische media, de aandacht van de aandacht van middelbare scholieren aan het feit dat in dergelijke omstandigheden de oxidatie gepaard gaat met de vorming van diolen (ductomische alcoholen) en de hydroxylgroepen worden verbonden door de koolstofatomen , waartussen er een dubbele binding was:

IN Evenzo beschouwen we de oxidatie van acetyleen en zijn homologen, afhankelijk van welke het milieu oplevert. Dus we specificeren dat in een zure omgeving het oxidatieproces vergezeld gaat van de vorming van carbonzuren:

De reactie wordt gebruikt om de structuur van alkins op oxidatieproducten te bepalen:

In neutrale en low-alkalische media wordt de oxidatie van acetyleen vergezeld door de vorming van geschikte oxalaat (zouten oxaalzuur), en de oxidatie van homologen is een uitsplitsing van drievoudige bindingen en de vorming van carbonzuurzouten:

IN De CE-regels worden uitgevoerd met studenten op specifieke voorbeelden, wat leidt tot een betere absorptie van hen theoretisch materiaal. Daarom, bij het bestuderen van de oxidatie van arena in verschillende omgevingen, kunnen studenten onafhankelijk suggereren dat zuurvorming moet worden verwacht in een zuur medium en in alkalische zouten. De leraar zal alleen worden verduidelijkt welke reactieproducten worden gevormd, afhankelijk van de structuur van de relevante arena.
Tonen op de voorbeelden die gomologen van benzeen met één zijketen (ongeacht de lengte) worden geoxideerd door een sterk oxiderend middel tot benzoëzuur door koolstofatoom. Gomezol homologen worden geoxideerd door kaliumpermanganaat in een neutraal medium om kaliumzouten van aromatische zuren te vormen.
5C 6 H 5 -CH3 + 6KMNO 4 + 9H2S04 \u003d 5C 6 H 5 COOH + 6MNSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5-C2H5 + 12KMNO 4 + 18H2S04 \u003d 5C 6 H 5 COOH + 5CO 2 + 12MNO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 -CH3 + 2KMNO 4 \u003d C6H 5 Cook + 2MNO 2 + KOH + H20.
We benadrukken dat als er verschillende zijketens in het molecuul zijn, dan in een zuur medium, elk van hen wordt geoxideerd volgens A-koolstofatoom op de carboxylgroep, waardoor polybente aromatische zuren worden gevormd:

P Ollinized vaardigheden om de vergelijkingen van de OSR voor koolwaterstoffen te compileren, kunt u ze gebruiken bij het bestuderen van de sectie "Oxygen-bevattende verbindingen".
Dus, bij het bestuderen van het thema "alcohol", vormen studenten onafhankelijk de vergelijking van alcoholoxidatie met behulp van de volgende regels:
1) Primaire alcoholen worden geoxideerd naar aldehyden
3CH 3 -CH2 OH + K2 CR2U 7 + 4H2S04 \u003d 3CHO 3 -CHO + K2S04 + CR2 (SO 4) 3 + 7H20;
2) Secundaire alcoholen worden geoxideerd naar ketonen

3) Voor tertiaire alcoholen is de oxidatiereactie niet kenmerk.
Om zich voor te bereiden op het examen, geeft de leraar advisatief aanvullende informatie aan de opgegeven eigenschappen, die ongetwijfeld nuttig zullen zijn voor studenten.
Met de oxidatie van methanol met een aangezuurde oplossing van kaliumpermanganaat of kaliumdichromaat, wordt CO 2 gevormd, primaire alcoholen tijdens oxidatie, afhankelijk van de omstandigheden van de reactie, niet alleen aldehyden vormen, maar ook zuren. Bijvoorbeeld, de oxidatie van ethanol met dichromaatkalium op koude uiteinden met een azijnzuurriem, en wanneer verwarmd - Acetaldehyde:
3CH 3 -CH2 OH + 2K2 CR20 7 + 8H2S04 \u003d 3CH 3 -COOH + 2K2S04 + 2CR 2 (SO 4) 3 + 11H 2 O,
3CH 3 -CH2 OH + K2 CR2U 7 + 4H2SUE 4 3CHO 3 -Cho + K2S04 + CR2 (SO 4) 3 + 7H 2 O.
We herinneren opnieuw de student op het effect van het medium op de producten van alcoholoxidatiereacties, namelijk: de hete neutrale oplossing van kmno 4 oxideert methanol tot kaliumcarbonaat, en de resterende alcoholen - tot zouten van de overeenkomstige carbonzuren:

Bij het bestuderen van het onderwerp "aldehyden en ketonen", benadrukken de aandacht van studenten over het feit dat aldehyden gemakkelijker zijn dan alcoholen, geoxideerd in de juiste carbonzuren, niet alleen onder de werking van sterke oxidatiemiddelen (zuurstof, aangezuurde oplossingen van KMNO 4 en K 2 CR20 7), maar en onder invloed van zwak (ammoniakoplossing van zilveroxide of koperhydroxide (II)):
5CH 3 -CHO + 2KMNO 4 + 3H2 SO 4 \u003d 5CH 3-COOH + 2MNO 4 + K2SUEN 4 + 3H 2 O,
3CH 3 -CHOEN + K2 CR20 7 + 4H2S04 \u003d 3CH 3 -COOH + CR2 (SO 4) 3 + K 2 SO 4 + 4H20,
CH 3 -CHO + 2OH CH 3-COONH 4 + 2AG + 3NH 3 + H 2 O.
Speciale aandacht wordt besteed aan de oxidatie van methanaal met ammoniakoplossing van zilveroxide, aangezien In dit geval wordt ammoniumcarbonaat gevormd en geen mierenzuur:
HCHEX + 4OH \u003d (NH 4) 2 CO 3 + 4AG + 6NH 3 + 2H 2 O.
Zoals onze vele jaren ervaring shows, de voorgestelde methodologie voor het leren van middelbare scholieren om de ORP-vergelijkingen met organische substanties te compileren, verhoogt hun eindresultaat van het examen in de chemie in verschillende punten.
De oxidatie van alkenen permanganaat kalium in een alkalisch medium tijdens het verwarmen (stijve omstandigheden) leidt tot de vernietiging van hun koolstofkelet op de dual verbindingssite. Tegelijkertijd, afhankelijk van het aantal alkylgroepen geassocieerd met het vinylfragment, kunnen twee carbonzuren, zuur en keton of twee ketonen worden verkregen:
UPRR.11.Welk product wordt gevormd tijdens de oxidatie van cyclohexien (A) verdunde kaliumpermanganaatoplossing in koud en (b) geconcentreerde kaliumpermanganaatoplossing met daaropvolgende verzuring.
UPR.12.Welke producten zijn gevormd uit 1,2-dimethylcyclohexen bij zijn (a) katalytische hydrogenering, (b) de oxidatie van kalium permanent kaliumpermanganaat in de koude, (c) ozonatie met daaropvolgende reducerende splitsing.
6.5. Ethyleenoxidatie in acetaldehyde
De oxidatie van ethyleenluchtzuurstof in de aanwezigheid van palladiumchloriden (II) en koper (II) leidt tot de vorming van Acetaldehyde ( Zweefproces):
 (63)
(63)
ethanal (Acetalaldehyde)
6.6. Chlooring ethyleen
Vinylchloride wordt verkregen door chlorogeneus ethyleen:
6.7. Oxidatieve ammonolyse
De oxidatie van koolwaterstoffen door luchtzuurstof in de aanwezigheid van ammoniak leidt tot de transformatie van de methylgroep in de Cyano-groep. Dergelijke oxidatie wordt oxidatieve ammonolyse genoemd. Acrylonitril wordt verkregen door oxidatie van propyleen.
acrylonitril
De oxidatieve ammonolyse van methaan wordt verkregen door een sinylzuur:
 (66)
(66)
7. Hydraulicatie van alkenen (oxosynthese)
Bij temperaturen van 30 tot 250 O C en een druk van 100-400 atm. In de aanwezigheid van Dicobaltoktacarbonyl komen alkenen aan bij waterstof en koolmonoxide met de vorming van aldehyden. Het mengsel van isomeren wordt meestal verkregen:
Mechanisme:
1. Decoratie van Liganda
2. Attachment ethyleen

3. De introductie van ethyleen

4. Liganda bevestigen
5. Implementatie van CO
6. Oxidatieve waterstofbijlage

7. Herstelopname

8. Toetreding van carbnes en carbenoïden
Recente jaren wordt veel aandacht in organische chemie betaald aan de verbindingen van bivalent carbon - carbenas. De meeste carbents zijn onstabiel en onmiddellijk na hun formatie reageren met andere verbindingen.
8.1. De structuur van Karbenov
Ongemerkt Carben: CH2, ook genoemd methyleen, kan in een singlet of triplet-vorm zijn. In de singlet vorm van carben bevinden zich twee voorzakende elektronen met gepaarde spins zich op hetzelfde orbitaal, terwijl in triplet-vorm, twee ongepareerde elektronen met parallelle spins zich op twee orbitalen van dezelfde energie bevinden. Verschillende elektronische configuraties van singlet en triplet carbenes worden weerspiegeld, zowel in verschillende geometrie van deze deeltjes als in verschillende chemische activiteiten. Een bivalent koolstof-koolstofatoom bevindt zich in een SP 2-hybride toestand, beide elektronen bevinden zich op SP 2-flexidale orbitalen (golf) en een P-orbital (NSMO) is gratis. Triplet Carben wordt gekenmerkt door SP-hybridisatie van bivalent koolstof; Tegelijkertijd bevinden zich twee ongepareerde elektronen op twee p-orbitalen, d.w.z. triplet carben is een biradical. De hoek van H-H - H voor singlet methyleen, volgens spectrale gegevens, is 102-105 0, en voor triplet methyleen, neemt deze hoek toe tot 135140 o. Dit komt overeen met een hogere stabiliteit van triplet methyleen. Volgens kwantum mechanische berekeningen is triplet methyleen echt 10 kcal / mol stabieler singlet methyleen.

De substituenten veroorzaken echter een verandering in de relatieve stabiliteit van deze twee vormen van carben. Voor dialkyl carben is een triplet-formulier ook stabieler, maar voor Digalokarben : CHAL 2, en andere karbnes met substituenten met een waterig elektronen, de hoofdtoestand is een singlet. De valentiehoek van C1-C-C1 voor Dichlorkarbena, gelijk aan 106 O, is goed in overeenstemming met de singlet-vorm. Hogere stabiliteit van de singlet-vorm van Digalocarbens in vergelijking met triplet, blijkbaar vanwege de stabilisatie vanwege het damppaar elektronen heteroatoom

Een dergelijke stabilisatie van de triplet-vorm van Digokarben is onmogelijk. Volgens de gegevens van de kwantum mechanische berekening is de energie van de singlet - de triplet-overgang voor Dichlorkarben 13,5 kcal / mol.
A. Dichlorkarben
Om Digalokarbenov te genereren, worden methoden op basis van de reactie van de elminatie van halogeenwaterstof uit trigalo-genen onder de werking van sterke gronden ontwikkeld. Deze methode was historisch gezien de eerste, met behulp waarvan de eerste van Karbenov werd gegenereerd als tussenligging - Dichlorkarben (J. Hein 1950). Wanneer interactie met ernstige basen van chloroform (RKA-chloroform is ~ 16), worden broomOormal (RCA \u003d 9) en andere trigalogomenomets een anion gevormd die wordt gestabiliseerd door het elimineren van het halogenide-ion met de vorming van Digocarben. Actie op chloroform van sterke basen wordt verkregen door Dichlorkarben:
dichlorkarben
Als basis kunnen ook lithiumorganische verbindingen in het onverschillige aprotische medium worden gebruikt. Dan kan onder -100 0 C worden vastgesteld in de vorming van trichloormethyllithium als tussenligging.

Met behulp van sterke basen zoals RLI, kunt u gecarbereerd genereren van 1,1-digalogenese-derivaten

In de afgelopen jaren, om in plaats daarvan digalokarben te genereren n.-Butilitia wordt veel gebruikt als een basis van bis (trimethylsilyl) natriumamide.
Tegelijkertijd wordt chemisch inert liefhebbend [bis (trimethylsilyl) amide] onderscheiden. BIS (trimethylsilyl) natriumamide, in tegenstelling tot N-butyllithium, kan in een inert atmosfeer in een droge vorm worden gescheiden. In de praktijk kunnen de essentiële oplossingen vaker worden gebruikt, die voor een lange tijd bij kamertemperatuur kan worden opgeslagen.
Dichlorkarben kan ook worden gegenereerd met thermische decarboxylering van natrium droog chlooracetaat:
Een van de meest betaalbare moderne werkwijzen voor het genereren van Dichlorkarbena uit chloroform onder de werking van natriumhydroxide in de omstandigheden van de interfaciale katalyse zal later in detail worden beschreven.
Dichlorkarben sluit zich aan bij Alkens, waardoor dichlorocyclopropanen. De verbinding treedt op stereospecifiek - de configuratie van het initiële alkeen wordt bewaard in het reactieproduct - de cyclopropaan:
 (69)
(69)
trance-2-buten trance-1,2-dimethyl-3,3-
dichloorclopropan
 (70)
(70)
cis-2-buten v.van-1,2-dimethyl-3,3-
dichloorclopropan
 (71)
(71)
7,7-dichlorubicycloheptan
Bij het herstellen van 1,1-digalocyclopropanen onder de actie van lithium in mPEM.-Butylalcohol, zink in azijnzuur of natrium in vloeibare ammoniak, worden zowel halogeenatomen vervangen door waterstof. Dit is een van de algemene werkwijzen voor het produceren van cyclopropaanderivaten.
bicyclicheptan.
UPR. elf.Voltooi de reactie:


(Z) -3-methyl-2-penteenmethyleenecyclohexaan
Antwoord

B. Methyleen
Methyleen kan worden verkregen door decompositie van diazomethaan. Diazomethaan is een relatief onstabiele substantie die ontleedt wanneer bestraling op stikstof en methyleen.
 (73)
(73)
diazetan
Methyleen: CH2 met een diazomethaan fotolidium wordt gevormd in een minder stabiele singlet-vorm. Singlet Methyleen Onder de reactieomstandigheden als gevolg van botsingen met diazomethaan of stikstofmoleculen verliest het snel energie en verandert in een stabieler triplet methyleen.
Voor Singlet Carbenis wordt het gekenmerkt door synchrone verbinding met de dubbele binding van alkeen met het volledige behoud van de geometrie bij een dubbele binding (reactie - cyclopeerverbinding). De bevestiging van de singletvorm van het carbenium voor een dubbele binding treedt op, dus strikt stereospecifiek.
B. Reactie Simmons-Smith
Effectieve en experimenteel, zeer eenvoudige werkwijze voor het omzetten van alkenen in cyclopropaanderivaten is gebaseerd op de reactie van alkenen met Iodistan Methyleen en zink en koperlegering. Deze reactie werd in 1958 geopend door Simmons en Smith en won onmiddellijk een brede populariteit in de synthese van cyclopropaanderivaten. Actief deeltje in deze reactie is niet carben : CH2, en carbenoid - jodide-joodethyl fietsen Iznch2 I, gevormd door de interactie van methyleenjodide en zink koperen paar.
diodmethaan iODomeomethylcinodide
(Real Simmons Smith)
 (75)
(75)
De reactie passeert het volgende mechanisme:

De Simmons Smith-reactie is een zeer gunstige methode om alkenen in de cyclopropane te converteren.
UPR. 12.Voltooi de reactie:


Antwoord
 (76)
(76)
metheylenecyclopentan spiroheptan.
 (77)
(77)
styreen cyclopropylbenzeen.
 Af hebben. Furnitura. Reparaties. Installatie. Keuze. Opening
Af hebben. Furnitura. Reparaties. Installatie. Keuze. Opening