Državni tehnološki institut salt Peterburg
(Tehnički univerzitet)
Odjel za organsko hemijsko fakultet 4
Grupa 476.
Kursni rad
Oksidacija alkena
Student ............................................. Rytin A.I.
Predavač .................................... ... St. Petersburg yu.l.
St. Petersburg
Uvođenje
1.Poksidacija (reakcija N.A. Prilezhev, 1909)
2. Hidroksilizacija
2.1anti -Hhydroksilacija
2.2sin -Hhydroksilacija
3. Iskrivljene cijepanje alkena
4.Omokloj
5. Društvo alkena u prisustvu paladium soli
Zaključak
Lista korištenih izvora
Uvođenje
Oksidacija je jedna od najvažnijih i uobičajenih transformacija organskih spojeva.
Pod oksidacijom u organskoj hemiji, procesi koji vode do iscrpljenosti spojeva s vodikom ili obogaćima sa kisikom. U ovom slučaju se odvija molekula elektrona. U skladu s tim, restauracija razumije odvajanje od organskog molekula kisika ili hidrogen priključice na njega.
U oksidativnim reakcijama, oksidizeri su jedinjenja sa velikim afinitetom za elektronsku (elektrofilu) i smanjujući agente - spojevi koji imaju tendenciju da se vrate elektroni (nukleofili). Jednostavnost oksidacije spojeva povećava se s rastom svoje nukleofilnosti.
Kada oksidiraju organske spojeve, u pravilu, ukupni prijenos elektrona i, u skladu s tim, ne pojavljuju se promjene u valenciji ugljičnih atoma. Stoga je koncept stupnja oksidacije uvjetni naboj atoma u molekuli, izračunati, na osnovu pretpostavke da se molekul sastoji samo od jona - samo uvjetni, formalni karakter.
U pripremi jednadžbi Redox reakcija potrebno je odrediti reducirati sredstvo, oksidirajući agent i broj posvećenih i primljenih elektrona. U pravilu su koeficijenti odabrani pomoću metode elektron-jonske ravnoteže (metoda polu-formacije).
U ovoj metodi tranzicija elektrona iz jednog atoma ili jona u drugi, uzimajući u obzir prirodu srednjeg (kiseline, alkalne ili neutralne) u kojoj reakcija. Da bi izjednačio broj atoma kisika i vodonika ili molekula vode i protona (ako se uvede kiseli medij) ili molekule vode i hidroksidni ioni (ako se uvodi alkalne ioni (ako se uvodi alkalne ioni (ako se uvede alkalni).
Dakle, prilikom pisanja poluprikovanja oporavka i oksidacije potrebno je nastaviti iz sastava jona koji su u rješenju. Nedostavljene, slabo rastvorljive ili plin koji se oslobađa u obliku plina trebaju biti napisani u molekularnom obliku.
Kao primjer, razmislite o procesu oksidacije etilena po razrjeđenim vodenim otopinom kalijuma permanganata (Wagner reakcija). Tijekom ove reakcije, etilen je oksidiran u etilen glikol, a kalijum permanganat vraćen je na manganski dioksid. Na dvostrukoj vezi su se pridruženi dva hidroksil:
3c 2 h 4 + 2kmno 4 + 4h 2 o → 3c 2 h 6 o 2 + 2mno 2 + 2HOH
Polu-reakcija oporavak: mno 4 ¯ + 2h 2 o + 3 e. → MNO 2 + 4OH ↑ 2Polu-reakcija oksidacije: C 2 H 4 + 2OH - - 2 e. → C 2 h 6 o 2 3
Napokon imamo u ionskom obliku:
2MNO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6Oh ¯ → 2MNO 2 + 8OH ¯ + 3C 2 h 6 O 2
Nakon obavljanja potrebnih rezova takvih članova, napišite jednadžbu u molekularnom obliku:
3c 2 h 4 + 2kmno 4 + 4 h 2 o \u003d 3c 2 h 6 o 2 + 2mno 2 + 2h.
Karakteristično za neke oksidante
Kiseonik
Zračni kisik se široko koristi u tehnološkim procesima, jer je najjeftinije oksidant. Ali oksigenacija zračnog kisika povezana je s poteškoćama povezanim sa kontrolom procesa, koji teče u različitim smjerovima. Oksidacija se obično vrši na visokim temperaturama u prisustvu katalizatora.
Ozon
Ozon O 3 koristi se za dobivanje aldehida i ketona ako ih je teško dobiti na druge načine. Najčešće se ozon koristi za uspostavljanje strukture nezasićenih spojeva. Ozon se dobiva pod djelovanjem mirnog električnog pražnjenja na kisiku. Jedna od značajnih prednosti ozonizacije, u usporedbi s kloriranjem, nedostaje toksina nakon obrade.
Kalijum permanganat
Permanganate kalijum najčešće se koristi oksidantizam. Reagens je topljiv u vodi (6,0% na 20 ° C), kao i u metanolu, acetonu i sirćetnu kiselinu. Za oksidaciju, vodene (ponekad acetone) rješenja KMNO 4 u neutralnom, kiselinom ili alkalnom medije. Prilikom provođenja procesa u neutralnom medijumu, magnezijumu, aluminija ili ugljičnom dioksidu dodaje se neutralizaciji hidroksida koji se oslobađa kalijum, dodaje se u reakcijsku masu. Reakcija oksidacije KMNO 4 u kiseloj mediju najčešće se vrši u prisustvu sumporne kiseline. Alkalni medij u oksidaciji stvara koh generirane tijekom reakcije ili se u početku dodaje u reakcijsku masu. U slabo alkalnim i neutralnim medijima, KMNO 4 oksidira jednadžbi:
KMNO 4 +. 3 e. + 2h 2 O \u003d K + + MNO 2 + 4OH ¯
u kiselom okruženju:
KMNO 4 +. 5 e. + 8h + \u003d K + + MN 2+ + 4H 2 O
Kalijev permanate koristi se za dobivanje 1,2-diola od alkena, sa oksidacijom primarnih alkohola, aldehida i alkilarena do karboksilnih kiselina, kao i za oksidativno razdvajanje karbonskih kostura preko više obveznica.
U praksi se obično koristi prilično veliki višak (više od 100%) KMNO 4. To se objašnjava činjenicom da je u normalnim uvjetima KMNO 4 djelomično raspada na mangan dioksid sa izdanje O 2. Dekomponirani koncentrirani H 2 Dakle 4 kada se zagrijava u prisustvu obnova eksplozije; Mješavine kalijuma permanganata sa organskim tvarima su takođe eksplozive.
Nadkislot
Peracetic i permaraye kiseline dobivaju se reakcijom 25-90% vodika peroksida s odgovarajućom karboksilnom kiselinom prema sljedećoj reakciji:
Rcooh + h 2 o 2 \u003d rcoooh + h 2 o
U slučaju sirćetne kiseline, ova ravnoteža postavljena je relativno sporo i ubrzati stvaranje vrhova obično dodaju sumpornu kiselinu kao katalizator. Formička kiselina je dovoljno jaka kako bi se osiguralo brzo uspostavljanje ravnoteže.
PenrofUnturUrace kiselina dobivena u mješavini sa trifluoroočetske kiseline reakcija trifluoroacetic anhidrida sa 90% vodikovog peroksida, još jačim oksidima. Slično tome, busna kiselina može se dobiti od sirćetskog anhidrida i vodika peroksida.
Posebno popularna firma m. -Hlorperbenzoic kiselina, jer je u proračunskom terkulaciji relativno siguran, prilično je stabilan i može se čuvati dugo vremena.
Oksidacija se događa zbog oslobođenog kiseonika ATOM-a:
Rcoooh \u003d rcoh + [o]
Nadcistritles se koriste za dobivanje epoksida iz alkena, kao i laktona iz alicikličkih ketona.
Vodikov peroksid
Vodonik peroksid je bezbojna tečnost, pomiješana sa vodom, etanolom i dietil eterom. 30% rješenja H 2 O 2 naziva se Perhidro. Visoko koncentrirani lijek može reagirati s organskim tvarima s eksplozijom. Prilikom skladištenja dekomiranja na kisik i vodu. Otpornost hidrogen peroksida povećava se s razrjeđivanjem. Za oksidaciju koriste se vodena rješenja različitih koncentracija (od 3 do 90%) u neutralnim, kiselim ili alkalnim medijima.
H 2 o 2 \u003d h 2 o + [o]
Radnja ovog reagensa na α, β-nenaseljeni karbonil spojevi u alkalnom mediju dobija se odgovarajućim epoksidaldehidi i ketonima, oksidacija karboksilnih kiselina u kiselom mediju sintetizovana je. Rješenje od 30% H 2 O 2 u sirćekovima oksidizira alkene u 1,2-diol. Koristi se vodikov peroksid: za dobivanje organskih i neorganskih peroksida, šljunčanih i perkarbonata na; Kao oksidirajući agent u raketnim gorivima; u pripremi epoksida, hidrokinona, pirocatehina, etilen glikola, glicerina, vulkanizacijskog akceleratora grupe Tyurama i sur; za izbjeljivanje ulja, masti, krzna, kože, tekstilnog materijala, papira; Za čišćenje Germanium i silicijum poluvodički materijal; kao dezinficijens za odlaganje domaćinstva i industrijskog otpadnih voda; u medicini; kao izvor 2 u podmornicima; H 2 O 2 dio je Fenton reagensa (FE 2 + H 2 O 2), koji se koristi kao izvor slobodnih radikala u organskoj sintezi.
Ruthenium Tetraxides i osmia
Tetraoksid Osmia Oso 4 - prah od bijelog do blijedo žute boje sa t. Pl. 40.6ºS; t. kip. 131,2ºS. Uklonjeva se na sobnoj temperaturi, topljivom u vodi (7,47 g u 100 ml na 25 ° C), CCL 4 (250 g otapala na 20 ° C). U prisustvu organskih spojeva, kovač zbog obnove u OSO 2.
Ruo 4 je zlatna žuta prizma sa t. Pl. 25.4ºS, primjetno se postiže na sobnoj temperaturi. Umjereno topiv u vodi (2,03 g na 100 ml na 20 ° C), vrlo dobro rastvorljiv u CCL 4. Jak oksidant od OSO 4. Iznad 100ºS eksplodira. Kao i osmijum tetraoksid ima veliku toksičnost i visoke troškove.
Ovi oksidizeri koriste se za oksidaciju alkena u α-glikoli u blagim uvjetima.
Ovaj materijal može se saviti u izražavanju samostalnosti, zbog velike količine informacija, mnogih nijansi, svih vrsta, ali ako. Pažljivo pročitajte!
O čemu ćemo tačno razgovarati?
Pored potpune oksidacije (izgaranje) za neke klase organskih spojeva karakterizira se reakcija nepotpune oksidacije, dok se pretvaraju u druge klase.
Postoje specifični oksidizeri za svake časove: Cuo (za alkohole), Cu (OH) 2 i OH (za aldehide) i druge.
Ali postoje dva klasična oksidazica koji su, ako su tako i izraženi, univerzalni za mnoge klase.
Ovo je kalijum permanganat - KMNO 4. I bihromat (dihromat) kalijuma - K 2 CR 2 O 7. Ove su tvari jaki oksidizeri zbog mangana u stupnju oksidacije +7, a hrom do stupnja oksidacije +6, respektivno.
Reakcije sa ovim oksidantima nalaze se prilično često, ali nigdje ne postoji holističko vodstvo, prema kojem principu biraju proizvode takvih reakcija.
U praksi postoji puno faktora koji utječu na tok reakcije (temperatura, medij, koncentracija reagenata itd.). Često ispada mješavinu proizvoda. Stoga, predvidjeti proizvod koji se formira gotovo nemoguće.
A za ispit nije prikladan: nemoguće je pisati "možda ili tako nešto, ili na neki drugi način ili mješavinu proizvoda." Potrebno je specifično.
Kompatelinski prevodioci uložili su određenu logiku, čiji je određeni princip trebao napisati određeni proizvod. Nažalost, nisu podijelili ni sa kim.
Ovo pitanje u većini pogodnosti prilično je klizanje od strane strane: dvije ili tri reakcije date su kao primjer.
Predstanka sam u ovom članku, šta se može nazvati rezultatima istraživačke analize zadataka upotrebe. Logika i principi sastavljanja oksidacijskih reakcija permanganata i dihromata solidarnosti prilično je velika tačnost (u skladu s npr. Standardima). O svemu po redu.
Određivanje oksidacije.
Prvo kada se bavimo redox reakcijama, uvijek postoji oksidirajuće sredstvo i smanjujući agent.
Oksidator je mangan u permanganatu ili hromira u dihromatu, smanjujući agent - atomi u organskom (naime, ugljični atomi).
Malo za identifikaciju proizvoda, reakcija se mora izjednačiti. Za prilagodbu tradicionalno koristite metodu elektronskog bilansa. Da biste primijenili ovu metodu, potrebno je odrediti stupanj oksidacije reduciranja sredstava i oksidatora prije i nakon reakcije.
Anorganske tvari stupnja oksidacije mogu biti u mogućnosti ocjenjivati \u200b\u200b9:
Ali u organizaciji, verovatno, u 9. razred nije određeno. Stoga prije učenja kako napisati OSR u organskoj hemiji, morate naučiti kako odrediti stepen ugljičnog oksidacije u organskim tvarima. To se učini malo drugačije, u suprotnom nego u neorganoj hemiji.
Ugljic ima maksimalni stepen oksidacije +4, minimalno -4. I može pokazati bilo koji stepen oksidacije ovog razmaka: -4, -3, -2, -1, 0, +1, +2, +3, +4.
Prvo se morate sjetiti šta je stepen oksidacije.
Stupanj oksidacije je uslovno naboj nastalo na atomu, kada pretpostavljamo da se elektronski parovi u potpunosti pomjeraju prema elektronegativnom atomu.
Stoga je stupanj oksidacije određeni brojem raseljenih elektroničkih parova: ako se pomakne na ovaj atom, dobija prekomjernu minus (-), ako je iz atoma, a zatim nabavlja prekomjerna plus (+). U principu, ovo je cijela teorija koju trebate znati da biste utvrdili stupanj oksidacije ugljičnog atoma.
Da bismo odredili stupanj oksidacije određenog ugljičnog atoma u spoju, moramo razmotriti svaku vezu i vidjeti u kojem smjeru će se elektronska parija biti pomaknuta i koji će višak (+ ili -) (+ ili -) rezultirati od ovoga na ugljičnom atomu.
Analiziraćemo posebne primjere:
Ugljik tri veze sa vodikom. Ugljik i vodonik - koji je više elektronegigati? Carbon, to znači, na ove tri obveznice, elektronski par će se prebaciti na ugljik. Carbon uzima svaki vodonik za jednu negativnu naboju: Ispada - 3
Četvrta veza sa hlorom. Ugljik i hlor - ko je više elektronegable? Hlor, to znači, na toj vezi, elektronski par će se prebaciti na hlor. Ugljič se pojavljuje jedna pozitivna naknada +1.
Zatim, samo trebate saviti: -3 + 1 \u003d -2. Stupanj oksidacije ovog ugljičnog atoma: -2.

Definiramo stupanj oksidacije svakog ugljičnog atoma:

Carbon ima tri veze sa vodonikom. Ugljik i vodonik - koji je više elektronegigati? Carbon, to znači, na ove tri obveznice, elektronski par će se prebaciti na ugljik. Carbon uzima svaki vodonik za jednu negativnu naboju: Ispada - 3
I još jedna veza sa drugim ugljikom. Ugljični i drugi ugljik - Njihova elektronaponosljivost su jednaki, pa se ne dogode elektronički raseljenje para (veza nije polarna). 

Ovaj atom ima dvije veze s jednim atomom kisika, a još jedan odnos sa drugim atomom kisika (kao dio OH grupe). Više elektronegativnih atoma kisika u tri obveznice odgađaju elektronički par iz ugljika, pojavit će se ugljen +3.
Četvrti krakorbon povezan je s drugim ugljikom, jer smo već izgovorili, na ovoj vezi je elektronski par ne pomaknut.


Dvije veze, ugljen povezan je s atomima vodika. Uglica, kao što je više elektronegacija kasnio na jedan par elektrona za svaku vezu s vodikom, stječe punjenje -2.
Dvostruko ropstvo ugljika povezano je sa atomom kisika. Više elektronegativnih densita kisika Jedan elektronski par za svaku vezu. Zajedno se ispostavilo u ugljiku, dva elektronička parova odgađaju se. Carbon stječe +2 naboja.
Zajedno se ispostavilo +2 -2 \u003d 0.

Definiramo stupanj oksidacije ovog ugljičnog atoma:
Trostruki odnos s više elektronegativnog azota - daje štednjak od ugljika +3, zbog ugljičnog pristranosti ugljika se ne pojavljuje.

Oksidacijska permanganata.
Šta će se dogoditi sa trajanjama?
Redox reakcija s permanganatom može teći u različitim medijima (neutralan, alkalan, kiselina). A ovisi o okolišu, kao što će reakcija teći i koji proizvodi se formiraju.
Stoga može ići u tri smjera:

Permanganat, biti obnovljen oksidant. Evo proizvoda njegovog oporavka:
- Medijum za aclest.
Srijeda je zakiseljena sumporna kiselina (H 2 SO 4). Mangan se vraća u stepen oksidacije +2. I proizvodi za oporavak bit će:
KMNO 4 + H 2 SO 4 → MNSO 4 + K 2 SO 4 + H 2 O
- Alkalno okruženje.
Da bi se stvorio alkalni medij, dodaje se prilično koncentrirana alkalija (koh). Mangan se vraća u stupnju oksidacije +6. Proizvodi za oporavak
Kmno 4 + koh → k 2 mno 4 + h 2 o
- Neutralno okruženje (i slabo alkalo).
U neutralnom mediju, pored permanganata, voda takođe ulazi u reakciju (koju pišemo na lijevoj strani jednadžbe), mangan će biti vraćen na +4 (MNO 2), proizvodi za oporavak bit će:
KMNO 4 + H 2 O → MNO 2 + KOH
I u blago alkalnom medijumu (u prisustvu rješenja niske koncentracije Koh):
Kmno 4 + koh → mno 2 + h 2 o

Šta će se dogoditi organskom?
Prvo što trebate naučiti je sve počinje sa alkoholom! Ovo je početna faza oksidacije. Oksidacija je podvrgnuta tom ugljiku na koju je hidroksilna grupa priključena.
Tokom oksidacije, ugljični atom "stječe" vezu sa kisikom. Stoga, kada je napisana shema reakcije oksidacije, [o] je napisano iznad strelice:
Primarni alkohol Oksidi prvo do aldehide, zatim u karboksilnu kiselinu:

Oksidacija sekundarni alkohol U drugoj fazi. Budući da je ugljik predaj, formiran je keton, a ne aldehid (ugljeni atom u keton grupi već fizički ne može formirati obveznica sa hidroksilskom grupom):

Ketones, tercijarni alkoholi i karboksilne kiseline Sledeće više ne oksidiraju:

Proces oksidacije koja je zakoračena - dok postoji gdje se za oksidiraju i postoje svi uvjeti za to - reakcija dolazi. Sve se završava s proizvodom koji u ovim uvjetima ne oksidira: tercijarni alkohol, keton ili kiselina.
Vrijedi napomenuti fazu oksidacije metanola. Pored toga, oksidiran je na odgovarajući aldehid, a zatim do odgovarajuće kiseline:

Posebnost ovog proizvoda (formenska kiselina) je da je ugljik u karboksilu povezan s vodikom, a ako pogledate pažljivo, možete vidjeti da to nije ništa drugo do aldehide grupe:

A aldehide grupa, kao što smo saznali ranije, oksidiran je u karboksil:

Prepoznao rezultirajuću supstancu? Njegova bruto formula H 2 CO 3. Ovo je koalična kiselina koja dezintegrira ugljični dioksid i vodu:
H 2 CO 3 → H 2 O + CO 2
Stoga su metanol, mrav aldehid i forme kiseline (na štetu aldehidske grupe) oksidirani u ugljični dioksid.
Meka oksidacija.
Meka oksidacija je oksidacija bez jakog grijanja u neutralnom ili blago alkalnom mediju (preko reakcije piše se 0 ° ili 20. °) .
Važno je zapamtiti da alkoholi nisu oksidirani u blagim uvjetima. Stoga, ako se formiraju, tada oksidacija i zaustavljanja. Koje će se tvari pridružiti reakciji meke oksidacije?
- Sadrži dvostruku obveznicu C \u003d C (Wagner reakcija).
Istovremeno, π-obveznica je slomljena, a oslobođene obveznice "sjede" na hidroksilskoj grupi. Ispada dvostruki alkohol:

Napišemo reakciju meke oksidacije etilena (ethen). Pišemo početne materijale i predviđamo proizvode. Istovremeno, H 2 O i COH još ne pišu: mogu se pokazati da su u desnom dijelu jednadžbe i s lijeve strane. I odmah odrediti stupanj oksidacije sustava supstanci:

Napravit ćemo elektroničku ravnotežu (mislimo da je redukcioni agent dva - dva atoma ugljika, oni su oksidirani odvojeno):

Odaberite koeficijente:

Na kraju je potrebno dodati nedostajuće proizvode (H 2 O i Koh). Pravo nedostaje kalijum - znači da će alkalija biti u pravu. Koeficijent stavljamo pred sobom. S lijeve strane nema dovoljno vodika, to znači da je voda ostavljena. Stavili smo koeficijent ispred sebe:

To radimo sa propilen (propan):


Često fit cikloalkane. Neka te ne osramoti. Ovo je konvencionalni ugljikovodik sa dvostrukom obvezom:

Gdje god je ta dvostruka veza bila, oksidacija će ići podjednako:

- Sadrži aldehide group.
Aldehide grupa je reaktivnija (lakše je reagirati) od alkohola. Stoga će aldehid biti oksidiran. Do kiseline:

Razmislite o primjeru acetaldehida (Ethanle). Pišemo reagense i proizvode i stavljamo stepen oksidacije. Napravit ćemo ravnotežu i stavili koeficijente prije reduciranog agenta i oksidirajućih sredstava:

U neutralnom mediju i blago alkalnom toku reakcije bit će malo drugačiji.
U neutralnom medijumu, kako se sjećamo, na lijevoj strani jednadžbe pišemo vodu, a u desnom dijelu alkalne jednadžbe (formirane tokom reakcije):

U ovom slučaju, kiselina i alkalija nalaze se u jednoj smjesi. Neutralizacija dolazi.

Ne mogu postojati u blizini i reagirati, oblici soli:
Istovremeno, ako pogledamo koeficijente u jednadžbi, shvatit ćemo da su kiseline 3 moleća, a alkali 2 mole se. 2 Moleći Alkali može neutralizirati samo 2 moležnu kiselinu (formiraju se 2 molite ih). I jedan minjak kiseline ostaje. Stoga će konačna jednadžba biti takva:

U blago alkalnom medijumu, to je alkalija u višku - dodaje se reakciji, tako da je sva kiselina neutralizirana:

Slična se situacija događa kada je metanal oksidiran. On, kao što se sećamo, oksidiran u ugljični dioksid:

Treba imati na umu da je ugljeni oksid (iv) co 2 kiseo. I reagirat će s Alkalijem. A budući da je ugaljna kiselina dvoosna, može se formirati i kisele soli i prosjek. Ovisi o omjeru između alkalnog i ugljičnog dioksida:
Ako se alkalija odnosi na ugljični dioksid kao 2: 1, tada će biti prosječna sol:
Ili Alkali može biti znatno više (više od dva puta). Ako je više od dva puta, tada će ravnoteža alkalije ostati:
3HOH + CO 2 → K 2 CO 3 + H 2 O + KOH
To će se pojaviti u alkalnom mediju (u kojem se višak alkalije, jer se dodaje reakcijskoj smjesi na reakciju) ili u neutralnom okruženju kada se Alkalija formira puno.
Ali ako se alkalija odnosi na ugljični dioksid kao 1: 1, to će biti kisela sol:
KOH + CO 2 → KHCO 3
Ako je ugljični dioksid veći nego što vam treba, ostaje višak:
Koh + 2CO 2 → KHCO 3 + CO 2
Ovo će biti u neutralnom okruženju ako se Alkalija formira nedovoljan.
Napišemo izvorne supstance, proizvode, uravnotežit ćemo ravnotežu oksidacije ispred oksidansnog sredstva, smanjujući agent i proizvode koji su formirani od njih:

U neutralnom mediju do desne formirat će alkali (4KOH):

Sada je potrebno shvatiti šta će se formirati interakcijom tri mola sulaka CO 2 i četiri alkalne mole.
3CO 2 + 4KOH → 3khco 3 + koh
KHCO 3 + KOH → K 2 CO 3 + H 2 O
Stoga se pokaže ovako:
3CO 2 + 4HOH → 2kHCO 3 + K 2 CO 3 + H 2 O
Stoga, u pravom dijelu jednadžbe napisamo dvije molitvene žljebove i jedan krticu karbonata:

I u slabo alkalno okruženje ne postoje takvi problemi: zbog činjenice da će alkalni višak formirati prosječnom soli:

Isto će biti i na oksidaciji aldehide oksalične kiseline:

Kao i u prethodnom primjeru formira se dibazijska kiselina, a 4 moleći alkalije treba biti na jednadžbi (kao 4 molitljiva permanganata).
U neutralnom okruženju, opet, cijela alkalija nije dovoljna za potpunu neutralizaciju cijele kiseline.
Tri moleći alkalije prolaze na stvaranje kiselog soli, jedan krtica Alkalija ostaje:
3hooc-cooh + 4KOH → 3KOC-Cooh + Koh
A ovaj Mol Alkali ulazi u interakciju s jednom kiselinom soli:
Koc-Cooh + Koh → Kooc-Cook + H 2 O
Ispada ovako:
3Hoc-Cooh + 4KOH → 2KOC-Cooh + Kooc-Cook + H 2 O
Kraj jednadžbe:

U slabo alkalnom mediju, prosječna sol formira se zbog viška alkaliju:

- Sadrže trostruki odnosC.≡ C..
Sjećate se šta je bilo s mekom oksidacijom veza sa dvostrukom vezom? Ako se ne sjećate, pomaknite se nazad - sjetite se.
Π-Bond je gust, atomi ugljika pričvršćeni su duž hidroksilne grupe. Evo istog principa. Vrijedno je zapamtiti da postoje dvije π-obveznice u trostrukoj vezi. U početku se događa na prvoj π-komunikaciji:
Zatim na drugoj π-komunikaciji:

Struktura u kojoj jedan ugljik ATOM ima dvije hidroksilne grupe, izuzetno nestabilne. Kada se nešto ne može održati u hemiji, on se nastoji "padati". Voda padne, ovako:

Carbonyl grupa se dobiva.
Razmotrite primjere:
Etin (acetilen). Razmotrite faze oksidacije ove supstance:

Čišćenje vode:




Kao u prethodnom primjeru, u jednoj reakcijskoj mješavini kiseline i alkalija. Neutralizacija dolazi - obrasci soli. Kao što se može vidjeti koeficijent prije permanganate, Alkali će biti 8 molova, odnosno to je dovoljno za neutralizaciju kiseline. Kraj jednadžbe:

Razmislite o oksidaciji BOUDIN-2:

Čišćenje vode:

Ovdje se kiselina nije formirana, tako da nije potrebno prevariti neutralizaciju.
Reakcijska jednadžba:

Te razlike (između ugljičnog oksidacije s ruba i u sredini lanca) jarko su pokazale primjerom Pentine:

Čišćenje vode:

Ispada da je tvar zanimljive strukture:

Grupa Aldehide i dalje oksidira:
Napišemo početne materijale, proizvode koji određuju stupnjeve oksidacije, bit ćemo uravnoteženi, jednostavni koeficijenti prije oksidacijskog sredstva i smanjujući agent:

Alkali bi trebao formirati 2 gomile (od koeficijenta prije permanganate 2), stoga je cijela kiselina neutralizirana:

Tvrda oksidacija.
Tvrda oksidacija je oksidacija u kiseo, eliminirati Srednji. Kao i u neutralna (ili niska alkalna), ali kada se zagrijava.
U kiseloj mediju, takođe se zagrijava. Ali ta tvrda oksidacija ne ide u kiselim mediju, grijanje je preduvjet.
Koje će se tvari biti izložene tvrdi oksidaciji? (U početku ćemo analizirati samo u kiselo okruženju - a zatim dodavanje nijansa koje se događaju kada se oksidiraju u snažno alkoholno i neutralno ili slabo alkalno (prilikom grijanja) srednjeg sredstva).
Sa tvrdom oksidom proces ide na maksimum. Dok postoji ta oksidirana - oduzima oksidaciju.
- Alkoholi. Aldehidi.
Razmotrite oksidaciju etanola. Oksidirano je do kiseline:

Snimanje jednadžbe. Zapišemo početne materijale, proizvode OSR-a, stavljaju stepen oksidacije, čine ravnotežu. Podesite reakciju:

Ako se reakcija provodi na tačkom ključanja aldehide, kada će se formirati, isparavat će (odletjeti) iz reakcijske smjese, a ne toliko za oksidirati. Isti efekat se može postići u vrlo njenim uvjetima (slabi grijanje). U ovom slučaju pišemo aldehid kao proizvod:

Razmotrite oksidaciju sekundarnog alkohola na primjeru propanol-2. Kao što je već spomenuto, oksidacija se razbija u drugoj fazi (formiranje karbonilskog spoja). Budući da se formira keton, što nije oksidirano. Reakcijska jednadžba:

Oksidacija aldehida razmatra se na temu Ethannela. Oksidiran je i u kiselinu:

Reakcijska jednadžba:

Metan i metanol, kao što je spomenuto ranije, oksidiran u ugljični dioksid:

Metanal:

- Sadrži više obveznica.
U ovom slučaju, lanac je puknut u više komunikaciji. I atomi koji su formirali su oksidirani (nabavite vezu sa kisikom). Oxisions što je više moguće.
Kada se oblikovaju dvostruki pauze s ostataka, formiraju se karbonil spojevi (na donjem dijagramu: iz jednog Burpa - Aldehide, s druge - Keton)

![]()
Mi ćemo analizirati oksidaciju Pentena-2:

Oksidacija "Staklana":

Ispada da se formiraju dvije kiseline. Pišemo početne materijale i proizvode. Definiramo stupnjeve oksidacije u atomima, koji ga mijenjaju, budite uravnoteženi, izjednačite reakciju: 
Činići da elektronski saldo znamo da je redukcioni agent dva - dva atoma ugljika, oni su zasebno oksidirani:

Kiselina se neće uvek formirati. Analizirat ćemo, na primjer, oksidaciju 2-metilbutetena:

Reakcijska jednadžba:

Apsolutno isti princip kada oksidirajuće jedinjete sa trostrukim vezama (samo oksidacija je odmah sa formiranjem kiseline, bez intermedijarnog formacije aldehide):

Reakcijska jednadžba:

Kad se višestruka veza nalazi tačno u sredini, a ne dva proizvoda, već jedan. Budući da su "ostaci" isti i oksidirani su u iste proizvode:

Reakcijska jednadžba:

- Dva puta kruna kiselina.
Postoji jedna kiselina da su karboksilne grupe (krunice) međusobno povezane:
Ovo je sorvana kiselina. Dvije krunice su teško slagati se. Sigurno je stabilan u normalnim uvjetima. Ali zbog činjenice da su u njemu dvije karboksilne grupe povezane jedni s drugima, manje je stabilna od ostalih karboksilnih kiselina.
I zato, s posebno oštrim okruženjima može se oksidirati. Postoji pauza između "dvije krune":

Reakcijska jednadžba:

- Gomolozi benzena (i njihovih derivata).
Sam Benzol nije oksidiran, zbog činjenice da aromatic čini ovu strukturu vrlo stabilnom 
Ali njegove su homologe oksidiraju. U isto vrijeme, lanac se odmori, glavna stvar je znati gdje tačno. Postoje neki principi:
- Sam benzinski prsten ne uništava i ostaje do kraja do kraja, puknuća komunikacije događa se u radikalu.
- Oksiša atom direktno povezan sa benzenskim prstenom. Ako, nakon njega, ugljični lanac u radikalu se nastavlja - tada će jaz biti nakon toga.


Mi ćemo analizirati oksidaciju metil benzena. Postoji jedan ugljeni atom u radikalnim oksidira: 
Reakcijska jednadžba:

Analizirat ćemo oksidaciju izobutilbenzena:

Reakcijska jednadžba:

Mi ćemo analizirati oksidaciju drugog butilbenzena:

Reakcijska jednadžba:

U oksidaciji gomologa benzena (i derivata homologa) sa nekoliko radikala formiraju se dvije tri i više aromatičnih kiselina. Na primjer, oksidacija 1,2-dimetilbenzena:

Derivati \u200b\u200bhomologa benzena (u kojem benzenski prsten nije ugljovoradni radikali), oksidiraju isto. Druga funkcionalna grupa ne miješa se u benzenski prsten:


Subtotal. Algoritam "Kako zabilježiti odgovor tvrde oksidacijskog permanganata u kiselo okruženje":
- Snimanje startnih materijala (organski + KMNO 4 + H 2 SO 4).
- Pišite organske oksidacijske proizvode (spojevi koji sadrže alkohol, aldehide grupe, višestruke obveznice, kao i benzenske homologije).
- Napišite proizvod za oporavak permanganate (MNSO 4 + K 2 SO 4 + H 2 O).
- Odrediti stupnjeve oksidacije od sudionika OSR-a. Ravnoteža. Klizite koeficijente oksidiračkog sredstva i smanjujući agent, kao i supstance koje su formirane od njih.
- Tada se preporučuje izračunavanje koliko sulfatnih anija u desnom dijelu jednadžbe, u skladu s tim stavljaju koeficijent pred sumpornom kiselinom s lijeve strane.
- Na kraju stavite koeficijent prije vode.
Tvrda oksidacija u snažno alkalnom medijumu i neutralnom ili slabo alkalnom (prilikom zagrevanja).
Te su reakcije mnogo manje uobičajene. Može se reći da su takve reakcije egzotične. I kao što bi to trebalo napraviti bilo kakvim egzotičnim reakcijama, to su bili najprokretni su.
Tvrda oksidacija je kruta u Africi, tako da je organsko oksidirano na isti način kao u kiselom okruženju.
Odvojeno, nećemo rastaviti reakciju za svaki razred, jer je opći princip već naveden ranije. Mi ćemo analizirati samo nijanse.
Eliminirati okruženje :
U snažno algi, permanganat se vraća u stupnju oksidacije +6 (kalijum manganit):
Kmno 4 + koh → k 2 mno 4.
U jakom alkalnom alkalu, uvijek postoji višak, tako da će se održavati potpuna neutralizacija: ako se u ugljen dioksid formira - bit će karbonat - ako se formira kiselina - bit će i sol (ako je kiselina srednja sol).
Na primjer, oksidacija propolena:

Etilbenzenska oksidacija:

Naljepnica ili neutralni medij prilikom zagrijavanja :
Također treba uvijek uzeti u obzir mogućnost neutralizacije.
Ako se oksidacija teče u neutralnom mediju, a stvoren je kiseo spoj (kiselina ili ugljični dioksid), tada će rezultirajući alkohol neutralizirati ovu kiselinu. Ali ne uvijek je uvijek alkalija dovoljan za potpunu neutralizaciju kiseline.
Kada se aldehidi oksidiraju, na primjer, nije dovoljno (oksidacija će nastaviti na isti način kao u blagim uvjetima - temperatura jednostavno ubrzava reakciju). Stoga se formira sol i kiselina (preostali približno govoreći višak).
Razgovarali smo o tome kada rastavljaju meku oksidaciju aldehida.
Stoga, ako se kiselina formira u neutralnom okruženju, morate pažljivo izgledati ako je dovoljno za neutralizaciju cijele kiseline. Posebnu pažnju treba posvetiti neutralizaciji polipnih kiselina.
U blago alkalnom medijem formiraju se samo srednje soli zbog dovoljnog broja alkalija, kao i alkalnog viška.
U pravilu je alkalija tokom oksidacije u neutralnom medijumu dovoljna. A reakcijska jednadžba koja je neutralna da će u slabo alkalnom mediju biti isti.
Na primjer, analizirat ćemo oksidaciju etilbenzena:


Alkali je dovoljan za potpunu neutraliziranje kiselih spojeva, čak i višak ostataka:

3 Moleći Alkali se konzumira - 1 ostaje.
Kraj jednadžbe:

Ova reakcija u neutralnom i nisko-alkalnom medijumu preći će podjednako (ne postoji alkalni u niskom alkalnom mediju, ali to ne znači da nije, to jednostavno ne unosi reakciju).
Redox reakcije koje uključuju dihromate (bihromat) kalijuma.
Bichromat nema tako širok izbor organskih reakcija oksidacije na ispitu.
Oksidacija bihromata obično se vrši samo u kiselom okruženju. Uz ovaj kromijum obnovljen je +3. Proizvodi za oporavak:
Oksidacija će biti teška. Reakcija će biti vrlo slična oksidaciji permanganata. Iste tvari će oksidirati da ih je oksidiran permanganatom u kiselom okruženju, formiraju se isti proizvodi.
Mi ćemo analizirati neke reakcije.
Razmotrite oksidaciju alkohola. Ako izvršimo oksidaciju na tačkom ključanja Aldehida, draga će njihova reakcijska smjesa, bez izloženog oksidaciji:

Inače, alkohol se može direktno oksidirati u kiselinu.
Aldehid, dobijen tokom prethodne reakcije, može se "uhvatiti" i učiniti ga oksidiranim u kiselinu:

Oksidacija cikloheksanola. Cikloheksanol je sekundarni alkohol, pa se Ketone formira:

Ako je teško odrediti stupanj oksidacije atoma ugljika takvom formulom, može se oslikati na nacrtu:

Reakcijska jednadžba:

Razmotrite oksidaciju ciklopentena.
Dvostruka obveznica se lomi (ciklus se otvara), atomi koji se formiraju oksidiraju na maksimum (u ovom slučaju, u karboksilnu grupu):


Neke karakteristike oksidacije na ispitu, s kojima se ne slažemo sasvim ne slažemo.
Ta "pravila", principi i reakcije o kojima će se raspravljati u ovom odjeljku, smatramo da ne u potpunosti tačno. Oni su u suprotnosti ne samo stvarnom stanju (hemija kao nauka), već i internu logiku školskog programa i posebno ispit.
Ali ipak, primorani smo da ovaj materijal damo upravo u obliku koji ispit zahtijeva.
Bit će riječ o tvrdi oksidaciji.
Sjećate se kako su gomolozi oksidirani i njihovi su izrečeni u oštrim uvjetima? Radikali su u potpunosti slomljeni - formiraju se karboksilne grupe. Ostaci su izloženi oksidaciji već "samostalno":

Dakle, ako je hidroksilna grupa iznenada radikalna, ili višestruka komunikacija, morate zaboraviti da postoji benzenski prsten. Reakcija će ići samo na ovu funkcionalnu grupu (ili višestruku komunikaciju).
Funkcionalna grupa i višestruki komunikacijski goster od benzenskog prstena.

Mi ćemo analizirati oksidaciju svake tvari:
Prva supstanca:

Ne smijete obratiti pažnju na činjenicu da postoji benzenski prsten. Sa stanovišta upotrebe je samo sekundarni alkohol. Sekundarni alkoholi su oksidirani u ketone, a ketoni nisu oksidirani:

Neka ova supstanca oksidira bihromate:

Druga supstanca:

Ova supstanca je oksidirana, jednostavno kao dvostruko povezana veza (ne obraćamo pažnju na benzenski prsten):

Neka je oksidiran u neutralnom permanganatu prilikom zagrijavanja:

Formirana alkalija dovoljno za potpunu neutraliziranje ugljičnog dioksida:
2h + CO 2 → K 2 CO 3 + H 2 O
Ukupna jednadžba:

Oksidacija treće supstance:

Pretpostavimo da će oksidacija prepustiti kalijum permanganat u kiselom okruženju:

Oksidacija četvrte stvari:

Oksidiran je u StrongShop medijumu. Reakcijska jednadžba će biti:

Pa, konačno, tako je oksidiran vinylbenzene:

I oksidiran je u benzoičnu kiselinu, potrebno je imati na umu da je prema logici ispita toliko oksidiran jer je to izvedenik benzena. I zato što sadrži dvostruku vezu.
Zaključak.
Sve je to što trebate znati o redox reakcijama koji uključuju permanganat i bihromat u organskom.
Nemojte se iznenaditi ako su neki trenuci navedeni u ovom članku, čujete prvi put. Kao što je već spomenuto, ova je tema vrlo opsežna i kontradiktorna. I uprkos tome iz nekog razloga plaća izuzetno malo pažnje.
Kao što ste možda bili uvjereni, dva-tri reakcije ne objašnjavaju sve obrasce ovih reakcija. Ovdje vam treba integrirani pristup i detaljno objašnjenje svih trenutaka. Nažalost u udžbenicima i na internetskim resursima, tema se ne objavljuje u potpunosti ili se uopće ne objavljuje.
Pokušao sam eliminirati ove nedostatke i nedostatke i u potpunosti razmotriti ovu temu, a ne djelomično. Nadam se da sam ga upravljao.
Hvala vam na pažnji, svi ste dobri! Uspjesi u razvoju hemijskih nauka i ispitivanja ispitivanja!
4.5. Oksidacija alkena
Reakcije oksidacije Alkena preporučljivo je podijeliti na dvije velike grupe: reakcije u kojima se sačuvane kostur ugljika i reakcija oksidativnog uništavanja karbonskog kostura sa dvostrukim molekulom molekula. Prva grupa reakcija uključuje epoksidaciju, kao i hidroksilaciju, što rezultira formiranjem vilica (glikola). U slučaju cikličnih alkena za vrijeme hidroksilacije se formira na vilicu tranrence- ili cIS-Dioles. Druga grupa uključuje ozonolizu i reakciju iscrpne oksidacije alkena, što dovodi do formiranja različitih vrsta karbonilnih spojeva i karboksilnih kiselina.
4.5.a. Oksidacijske reakcije alkena dok održavaju karbonski kostur
1. Epoksidacija (reakcija N.A. Prilezhev, 1909 g)
Aciklični i ciklični alkeni kada komuniciraju sa peracidom (suprachlotes) rcoooh u ne-polarnom, ravnodušnom srednjem obliku epoksidi (oksizan), tako da se sama reakcija naziva epoksidacijskom reakcijom.
Prema modernoj nomenklaturi Jupak - tročlani ciklus sa jednim atomom kisika naziva se Oxira.
Epoksidacija alkena treba smatrati sinkronim, koordiniranim procesom u kojem se ne uključe ionski intermedijate vrste hidroksil kationa. Drugim riječima, epoksidacija alkena je proces sin- Troublete Jedan atom kisika za dual komunikaciju sa potpunim očuvanjem supstituentne konfiguracije u dvostrukoj vezi.
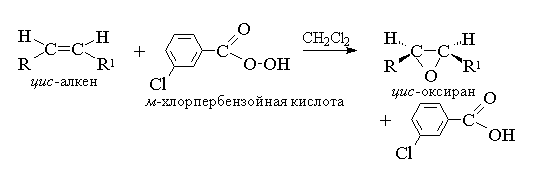

Za epoksidaciju je predložen mehanizam za dogovorene procese.

T. K. Dvokrevetni napad na napad kisika je jednako jednak obje strane dvostruke ravnine obveznica, ili su ili oksirane meso- Obrasci ili mješavine enantiomera. Sljedeće pecilu koriste se kao epoksidacijska sredstva: Pebenzoic, m.-Hlorperbenzoic, monoperfthal, persum, trifluorpere i trajni. Perkislote aromatične serije koriste se u obliku pojedinačnih reagensa, dok se perkisloti alifatičnih reda - CH 3 CO 3 H, CF 3 CO 3 H i NSO 3 N nisu izolirani pojedinačno, već se koriste nakon njihove formiranja tokom interakcije od 30% ili 90% hidrogen peroksida i odgovarajuće karboksilne kiseline. Perbenzoic I. m.-Hlorperbenzoična kiselina dobiva se oksidacijom, respektivno, benzoikom i m.-Hlorbenzoične kiseline sa 70% vodikovog peroksida u otopini metanezolfoničke kiseline ili od hlorida hidrata od ovih kiselina i vodikovog peroksida.


Monoperfththalatska kiselina dobiva se sličnom metodom od ftaličnog anhidridnog i 30% hidrogen peroksida.

U početku su pebenzoičke ili monoperftinske kiseline korištene za dobivanje oksiranesa (epoksidi):

Trenutno za epoksidaciju najčešće se koristi m.-Hlorperbenzoična kiselina. Za razliku od ostalih perkslota, stabilan je kada se pohranjuje duže vrijeme (do 1 godine) i apsolutno je siguran prilikom kontaktiranja. Oxirana dobiveni tokom oksidacije acikličkih i cikličkih alkena m.-Herperbenzoična kiselina u metilen hloridnom otopinu, hloroform ili dioxane, obično prilično visok.



Perkislote se često generiraju direktno u reakcijskoj mješavini 90% hidrogen peroksida i karboksilne kiseline u metilen hlorid.


Dvostruki alkeni povezani s karbonilskom grupom ili drugom supstituentnim supstituentima, nisko aktivni i za njihovu oksidaciju, bolje je koristiti jače oksidante, poput trifluoroprocus kiseline dobivene od trifluoroočetske kiseline anhidrid i 90% hidrogen peroksida u metilen hloridu. Najjednostavniji oksiran - etilen oksid dobiven je u industriji oksidacijom etilena kisikom u prisustvu srebra, kao katalizator.

2. anti-Hhydroksilacija
Tročlani prsten okrasa lako se otkriva pod djelovanjem širokog spektra nukleofilnih reagensa. Ove će se reakcije detaljno razmotriti u odjeljku posvećenom acikličkom i cikličkom jednostavnom eteru. Ovdje će se razmatrati samo hidroliza Oxyranes. Hidroliza oksirana kataliziraju obje kiseline i baze. U oba slučaja formiraju se vilice za vilice, tj. Glikoli. U kiselini u prvoj fazi atom kisika kiseonika protonira se na formiranje cikličkog oknonijumskog kationa, koja se otkriva kao rezultat nukleofilnog napada molekule vode:

Ključna faza u otkrivanju prstena, koja određuje brzinu cjelokupnog procesa je nukleofilni napad vodom na protoniranom obliku Oxirana. Sa stajališta mehanizma, ovaj proces je sličan objavljivanju bromonijevog jona sa nukleofilnim napadom bromidnog jona ili drugog nukleofilnog agenta. Sa ovih pozicija, stereohemijski rezultati trebaju biti obrazovanje tranrence- glikoli prilikom cijepanja cikličkih epoksida. Zaista, sa kiselo-katalizirana hidrolizom cikloheksenoksida ili ciklopenthoksida formirana je isključivo tranrence-1,2-diol.

Dakle, dva koraka epoksidacije alkene praćena od strane kiselog hidrolize epoksida ukupno odgovara reakciji anti- Hidroksilizacija alkena.
Obje faze anti- Hidroksilizma alkena može se kombinirati ako se alkene tretira vodenim 30-70% hidrogenom peroksidom u mrav ili trifluoroočetskoj kiselini. Obje ove kiseline su dovoljno jake da uzrokuju otkrivanje ciklusa oksirana.

Objavljivanje otporan na okraznim prstenom od baza također dovodi do stvaranja cikličkog tranrence-Likoli.

Shodno tome, dvostepeni proces epoksidacije alkena sa naknadnom alkalnom hidrolizom epoksida je takođe reakcija anti- Hidroksilizacija alkena.
3. sin-Hhydroksilacija
Neke soli i oksidi prijelaznih metala u najvišim stupnjevima oksidacije su efikasni reagensi. sin- Hidroksilacija dvostruke veze alkeneta kada su obje hidroksilne grupe pridružene s iste strane dvostruke veze. Oksidacija alkena permanganate kalijum - jedna od najstarijih metoda sin- Hidroksilizacija dvostruke komunikacije - i dalje se koristi široko, uprkos ograničenjima karakteristika za to. CIS-1.2-cikloheksanediola prvo je primio V.V. Markovnikov 1878. godine hidroksilacijom cikloheksa sa vodenom otopinom kalijuma permanganate na 0 0 C.

Ova metoda u budućnosti razvijena je u radovima ruskog naučnika E.E. Wagner, dakle sin- Hidroksilizacija alkena pod djelovanjem vodene otopine permanganata kalijuma naziva se Wagner reakcija. Kalijum Permanganat je jak oksidantizing agent koji ne može samo hidroksi dvostruka veza, već i podijeljena formiranje vilice za oblikovanje. Da bi se izbjeglo daljnje cijepanje glikola, potrebno je pažljivo pratiti uvjete reakcije. Izlazi glikola istovremeno su obično mali (30-60%). Najbolji rezultati postižu se u hidroksilaciji alkena u slabo alkalnom medijunu (pH ~ 8 9) na 0-5 0 s razrijeđenim sa 1% vodenom otopinom KMNO 4.


U početku je tokom oksidacije alkena permanganata kalijum, formiran je ciklički eter manganske kiseline, koji se odmah hidrolizira u vilju.

Ciklični ester manganske kiseline kao posrednika nije izoliran, ali njegova formacija slijedi iz eksperimenata s oznakom 18 na kalijevskom permanganatu: oba atoma kisika u glikolu označeni su kada je alkina oksidacija 18 o 4. To znači da se oba atoma kisika prelaze iz oksidansa, a ne iz otapala - vode, što je u dobrom prema predloženom mehanizmu.
Druga metoda sin- Hidroksilizacija alkena pod djelovanjem OSMiA oksida (VIII) OSO 4 predložila je R. Kryga 1936. godine. Osmia tetraoksid je bezbojan, leteći, kristalni, dobro topljiv u zraku, dioksanima, piridinama i drugim organskim otapalima. Kada osmijum tetraoksid u interakciji sa alkanima u zraku ili dioksanu, formiran je crni talog o osmešne kiselinom cikličkog estera - Osmat, koji se može lako izolirati pojedinačno. Dodavanje OSO 4 do dvostrukih obveznica primjetno se ubrzava u rješenju u piridin. Razgradnja osmastava na visine glikole postiže se djelovanjem vodenog natrijum hidrosulfita ili vodonika.

Izlazi iz proizvoda sin-Hydroksilacija alkena u ovoj metodi značajno je veća od korištenja permanganata kao oksidirajućih sredstava. Važna prednost Krig metode je odsustvo oksidativnih proizvoda za cijepanje alkena karakterističnih za oksidaciju permanganata.


Osmia Tetraoxide je vrlo skup i teško dostupan reagens, a toksičan je. Stoga se Osmia oksid (VIII) koristi u sintezi malih količina teških tvari kako bi se dobila najveći izlaz Diola. Da bismo pojednostavili sin-Hydroksilacija alkena pod djelovanjem OSO 4 razvijena je tehnikom koja nam omogućava da koristimo samo katalitičke iznose ovog reagensa. Alkene hidroksilacija se vrši pomoću vodika peroksida u prisustvu OSO 4, na primjer:

U zaključku ovog odjeljka dajemo stereohemijske odnose između alkena cIS- ili tranrence- Konfiguracija i konfiguracija formirane vilice za diol, koji mogu biti cIS- ili tranrence-Zeter, erytro- ili treo-Dobro meso- ili D, L.-Form, ovisno o poslanicima u alkenu:

Slične stereohemijske odnose se primijećuju u drugim reakcijama sin- ili anti- Tokom višestrukih ponuda vodonika, halogenerata, vode, halogena, borona hidratara i drugih reagensa.
Sastavljanje jednadžbi redox reakcija koje uključuju organske tvari
U Komunikacije sa uvodom kao jedini oblik konačnog certificiranja maturanata srednje škole jednog državnog ispita (upotrebe) i prelaska srednje škole za obuku profila postaje sve relevantnija za pripremu srednjoškolaca da bi se postigli najskuplje "skupo "Zadaci dela" sa "testom ispita u hemiji. Unatoč činjenici da se pet zadataka dela "C" smatraju različitim: hemijskim svojstvima anorganskih tvari, lanci pretvorbe organskih spojeva, izračunati zadaci - svi su na ovaj ili onaj način preciznih Redox reakcije (OSR). Ako se nauči glavno znanje o teoriji OSR-a, tada možete pravilno izvesti prve i druge zadatke, a treći je djelomično. Prema našem mišljenju, značajan dio uspjeha prilikom obavljanja dijela "C" je upravo u ovome. Iskustvo pokazuje da će, ako, proučavajući anorganske hemije, učenici dobro suočavaju sa zadacima pisanja OSR jednadžbi, slični zadaci organske hemije uzrokuju velike poteškoće. Stoga, tokom čitavog studija cjelokupnog kursa organske hemije na razredima profila, pokušavamo formirati vještine sastavljanja kompilacije OPR jednakosti u srednjoškolcima.
Prilikom proučavanja komparativnih karakteristika anorganskih i organskih spojeva, upoznajemo studente koristeći stupanj oksidacije (C.O.) (u organskoj hemiji, prije svega ugljikom) i metode za njegovu odlučnost:
1) Izračun srednjeg S.o. ugljik u molekuli organskog materija;
2) Definicija S.o. Svaki ugljični atom.
Navodimo u kojim slučajevima je bolje koristiti jedan ili drugi način.
Članak je objavljen uz podršku kompanije "Geo-inženjering", koji predstavlja proizvode na tržištu pod brendom "Profkresla". Opseg kompanije - proizvodnja, prodaja i ugradnja stolica i stolica za razne dvorane. Visoka profesionalnost osoblja i vlastiti proizvodni pogoni omogućuju vam brzo i efikasno provođenje projekta bilo kojeg stupnja složenosti. Svi proizvodi pod brendom "Profkresla", bile su tonatralne stolice, sjedala za čekaonice ili stolice za obrazovne ustanove, razlikuju moderan i ergonomski dizajn, kao i visoku otpornost na habanje, snagu i udobnost. Od ogromnog raspona proizvoda predstavljenih u katalogu na web mjestu Profkresla.ru, uvijek možete odabrati modele koji su najbolji relevantni za korporativni stil usvojen u vašoj kompaniji. Ako još uvijek imate poteškoća s izborom, stručnjaci kompanije su uvijek spremni dati savjet, pomoći da odluči o modelu, nakon čega je pripremiti projekt, na licu mjesta za proizvodnju svih potrebnih mjerenja i ugradnje.
P Studija teme "Alkana" pokazuje da procesi oksidacije, sagorijevanja, halogeniranja, nitracije, dehidracije, dekompozicije odnose se na redoks procese. Pri pisanju jednadžbi reakcija i raspadanja organskih tvari, bolje je koristiti prosječnu vrijednost C.O. Ugljik. Na primjer:
Skrećemo pažnju na prvu polovinu elektronskog bilansa: u atomu ugljika u frakcijskoj vrijednosti C.O. Denominator je 4, tako da se izračunavanje elektronskog prijenosa vrši u skladu s ovim koeficijentom.
U drugim slučajevima, prilikom proučavanja tema "Alkans", utvrđujemo vrijednosti S.o. Svaki atom ugljika u spoju, skrećući pažnju studenata na redoslijed zamjene atoma vodonika u primarnom, sekundarnom, tercijarnom ugljičnom atomu:


Dakle, sakupljamo studente u zaključku da je proces supstitucije u tercijarnom, zatim u sekundarnom, i, prošli put - u primarnim atomima ugljika.
P Studija teme "Alkenes" razmatra oksidacijske procese ovisno o strukturi alkeneta i reakcijskog medija.
Kada su alkeni oksidirani koncentriranim otopinom kalijuma permanganate KMNO 4 u kiseloj srednjoj (kruti oksidaciji), pojavljuje se prekid - i -Cons sa formiranjem karboksilnih kiselina, ketona i karbonskih oksida (IV). Ova se reakcija koristi za određivanje položaja dvostruke veze.
Ako je dvostruka veza na kraju molekule (na primjer, na BOUHENA-1), jedan od oksidacijskih proizvoda je formalna kiselina, lako oksidiran u ugljični dioksid i vodu:

Naglašavamo da ako u molekulu u Alkin u dvostrukoj vezi sadrži dva supstituela ugljika (na primjer, u 2-metilbutene-2 \u200b\u200bmolekulu), zatim kada se tiče oksidacije, dolazi do obloge ketona, jer se konverzija takvog atoma u atom karboksilne grupe nemoguć je bez razbijanja C-C-komunikacije, relativno stabilne pod ovim uvjetima:

Spericijamo da ako je molekula Alkina simetrična, a dvostruka veza sadrži na sredini molekule, formira se samo jedna kiselina tokom oksidacije:

Obavještavamo da je karakteristika oksidacije alkena u kojima se ugljeni atomi na dvostrukoj vezi sadrže dva ugljična radikala, formiranje dva ketona:


S obzirom na oksidaciju alkena u neutralnim ili slabo alkalnim medijima, fokusirajući pažnju srednjoškolaca na činjenicu da u takvim uvjetima oksidacija prati formiranje vojnika (dukkoholnih alkohola), a hidroksilne grupe), a hidroksilne grupe pridružene su ugljičnim atomima , između kojih je postojala dvostruka veza:

U Slično tome, smatramo oksidacijom acetilena i njegovih homologa, ovisno o tome koji je okoliš prihod. Dakle, preciziramo da u kiselo okruženju, proces oksidacije prati formiranje karboksilnih kiselina:

Reakcija se koristi za određivanje strukture alkina na oksidacionim proizvodima:

U neutralnim i niskim alkalnim medijima popraćeno je oksidacijom odgovarajućeg oksalata (soli oksalične kiseline), a oksidacija homologa je slom trostrukih obveznica i formiranja soli karboksilnih kiselina:

U Pravila CE provode se sa studentima na konkretnim primjerima, što dovodi do bolje apsorpcije njih teorijski materijal. Stoga, prilikom proučavanja oksidacije arene u raznim sredinama, studenti mogu samostalno sugerirati da se u kiselojsko formaciji treba očekivati \u200b\u200bu kiselim medijima, a u alkalnim solima. Učitelj će biti razjašnjeno samo što se stvaraju reakcija ovisno o strukturi relevantne arene.
Prikazuje se na primerima koje benzene s jednim bočnim lancem (bez obzira na njenu dužinu) oksidiraju snažnim oksidansom do benzojske kiseline ugljičnim atomom. Gomezol homologije oksidiraju kalijum permanganat u neutralnom mediju koji bi formirali kalijum soli aromatičnih kiselina.
5c 6 h 5 -Ch 3 + 6kmno 4 + 9h 2 SO 4 \u003d 5c 6 h 5 Cooh + 6MNSO 4 + 3K 2 SO 4 + 14h 2 O,
5c 6 h 5 -c 2 h 5 + 12kmno 4 + 18h 2 SO 4 \u003d 5c 6 h 5 Cooh + 5CO 2 + 12MNSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 -CH 3 + 2kmno 4 \u003d C 6 H 5 Cook + 2MNO 2 + Koh + H 2 O.
Naglašavamo da ako u molekulu postoji nekoliko bočnih karana, a zatim u kiseloj mediju, svaki od njih je oksidiran u skladu s atomom ugljika u karboksilnu grupu, kao rezultat čije se formiraju polebrene aromatične kiseline:

P Ollinizirane vještine za sastavljanje jednadžbi OSR-a za ugljikovodike omogućuju vam da ih koristite prilikom proučavanja odjeljka "Spojevi koji sadrže kisik".
Dakle, prilikom proučavanja teme "alkohol", studenti samostalno čine jednadžbe oksidacije alkohola koristeći sljedeća pravila:
1) Primarni alkoholi su oksidirani u aldehide
3ch 3 -CH 2 OH + K 2 CR 2 O 7 + 4H 2 SO 4 \u003d 3CO 3 -Cho + K 2 SO 4 + CR 2 (SO 4) 3 + 7H 2 O;
2) Sekundarni alkoholi su oksidirani u ketone

3) za tercijarne alkohole, reakcija oksidacije nije karakteristična.
Da bi se pripremio za ispit, nastavnik savjetovan daje dodatne informacije navedenim svojstvima, što će nesumnjivo biti korisno za studente.
Uz oksidaciju metanola s zakisevljenim otopinom od kalijuma permanganata ili kalijum dihromata, CO 2 se formira, primarni alkoholi tokom oksidacije, ovisno o uvjetima reakcije, mogu formirati ne samo aldehide, već i kiseline. Na primjer, oksidacija etanola s dihromatičnim kalijumom na hladnim krajevima s octenom kiselinom, a kada se zagrijava - acetaldehid:
3ch 3 -CH 2 OH + 2K 2 CR 2 O 7 + 8H 2 SO 4 \u003d 3CH 3 -Cooh + 2k 2 SO 4 + 2CR 2 (SO 4) 3 + 11H 2 O,
3ch 3 -CH 2 OH + K 2 CR 2 O 7 + 4H 2 SO 4 3CO 3 -Cho + K 2 SO 4 + CR 2 (SO 4) 3 + 7H 2 O.
Opet se prisjećamo studentu na učinak srednjeg na reakcije s alkoholom oksidacije, naime: vruće neutralno rješenje KMNO 4 oksidizira metanol za kalijum karbonat, a preostale alkohole - soli odgovarajućih karboksilnih kiselina:

Prilikom proučavanja tema "Aldehidi i ketone", naglašavaju pažnju učenika o činjenici da su aldehidi lakši od alkohola, oksidiran u odgovarajuće karboksilne kiseline ne samo pod djelovanjem jakih oksidacijskih sredstava (kiseonik, zakisetih rešenja KMNO 4 i K 2 CR 2 O 7), ali i pod utjecajem slabe (amonijak otopina srebrnog oksida ili bakra hidroksida (II)):
5ch 3 -cho + 2kmno 4 + 3h 2 SO 4 \u003d 5CH 3 -Cooh + 2MNSO 4 + K 2 SO 4 + 3H 2 O,
3ch 3 -Cho + K 2 CR 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -Cooh + CR 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
Ch 3 -Cho + 2OH CH 3 -Coonh 4 + 2AG + 3NH 3 + H 2 O.
Posebna se pažnja posvećuje oksidaciji metanala s amonijačnim otopinom srebrnog oksida, od tada U ovom se slučaju formira amonijum-karbonat, a ne formenska kiselina:
HCHEX + 4OH \u003d (NH 4) 2 CO 3 + 4AG + 6NH 3 + 2H 2 O.
Kao što naša dugogodišnja iskustva pokazuje, predložena metodologija za učenje srednjoškolaca za sastavljanje orp jednadžbi koje uključuju organske tvari povećavaju svoj konačni rezultat ispita u hemiju u nekoliko točaka.
Oksidacija Alkenes Permanganate kalijum u alkalnom mediju za vrijeme grijanja (kruti uslovi) dovodi do uništavanja njihovog karbonskog kostura na dvostrukom mjestu povezivanja. Istovremeno, ovisno o broju alkilnih grupa povezanih s vinilnim fragmentom, mogu se dobiti dvije karboksilne kiseline, kiseline i keetona ili dva ketona:
UPR.11.Ono što se proizvod formira tijekom oksidacije cikloheksien (a) razblaženog kalijskog permanganate otopine u hladnom i (b) koncentriranom rješenju kalijuma permanganate s naknadnim zakiseljavanjem.
UPR.12.Koji su proizvodi formirani od 1,2-dimetilcycloheksena na svojoj (a) katalitičkom hidrogeniranju, (b) oksidacija trajnog kalijuma kalijuma u kalijumu na hladnoj, (c) ozonaciji s naknadnim smanjenjem cijevi.
6.5. Etilen oksidacija u acetaldehidu
Oksidacija etilenskog zržnog kisika u prisustvu paladijum hlorida (ii) i bakra (ii) dovodi do formiranja acetaldehide ( Proces bičja):
 (63)
(63)
etanal (acetaldehid)
6.6. Chloroising Ethilene
Vinil hlorid dobiva hlorogena etilena:
6.7. Oksidativna amonoliza
Oksidacija ugljikovodika zračnim kisikom u prisustvu amonijaka dovodi do transformacije metilne grupe u grupi cijano. Takva oksidacija naziva se oksidativnom amonolizom. Akrilonitril se dobija oksidacijom propilena.
akrilonitril
Oksidativna amonoliza metana dobiva sinilnu kiselinu:
 (66)
(66)
7. Hidraucilacija alkena (oksosinteza)
Na temperaturama od 30 do 250 o c i pritisak 100-400 bankomata. U prisustvu dicobAltoktacarbonyl, Alkenes se pridruže vodonik i ugljičnom monoksidu sa formiranjem aldehida. Smjesu izomerima se obično dobiva:
Mehanizam:
1. Dekoracija ligande
2. Pričvršćivanje etilena

3. Uvođenje etilena

4. Pričvršćivanje ligande
5. Implementacija CO
6. Oksidativni vodonik prilog

7. Pokupiti za oporavak

8. Pristupanje Carbnesa i karbenoida
Posljednjih godina, puno pažnje u organskoj hemiji isplaćuje se spojevima bivalentnog ugljika - karbena. Većina karata je nestabilna i odmah nakon njihove formiranja reagira s drugim vezama.
8.1. Struktura Karbenova
Nepaženi karben: CH 2, koji se naziva i metilen, može biti u singletu ili trostrukom obliku. U singletskom obliku karbena, dva nemoćna elektrona sa uparenim spinovima nalaze se na istoj orbitalu, dok su u trostrukim oblicima, dva nepokoračena elektrona sa paralelnim spinovima nalaze se na dvije orbite iste energije. Razne elektroničke konfiguracije singleta i trostrukih karbena odražavaju se u različitim geometri tih čestica i u raznim hemijskim aktivnostima. Bivalentni ugljični ugljik Atom nalazi se u SP 2-hibridnom stanju, oba elektrona nalaze se na SP 2-fleksibilnim orbitalima (val), a P-orbital (NSMO) je besplatan. Triplet Carben karakteriše SP-hibridizacija bivalentnog ugljika; Istovremeno, dva nepoštena elektrona nalaze se na dvije p-orbitale, tj. Triplet Carben je biradičan. Ugao H-H - H za singl metilen, prema spektralnim podacima, iznosi 102-105 0, a za triplet metilen, ovaj kut se povećava na 135140 o. To odgovara višoj stabilnosti triplet metilena. Prema kvantnim mehaničkim proračunima, triplet metilen je uistinu 10 kcal / mol stabilnijeg singlet metilena.

Zamjene, međutim, uzrokuju promjenu relativne stabilnosti ova dva oblika karbena. Za Dialkil Carben, trostruki oblik je takođe stabilnijeg singleta, ali za Digalokarben : Chal 2, a druga Carbnes sa supstituentima koji sadrže zaliven elektrona, glavna je država singlet. Ugao valencija C1-C-C1 za Dichlorkarbena, jednak 106 O, dobro je u skladu sa singletskim obrascem. Veća stabilnost singletskog oblika DigaloCarbens u odnosu na trostruku, očigledno zbog stabilizacije zbog pare para elektrona heteroatoma

Takva stabilizacija trostrukog oblika Digokarbena je nemoguća. Prema podacima kvantnog mehaničkog izračuna, energije singleta - trostruki tranzicija za dichlorkarben je 13,5 kcal / mol.
A. Dichlorkarben
Da bi se generiralo Digalokarbenov, izrađene su metode zasnovane na reakciji nasilje od halogenog vodika iz trikalo-gena pod djelovanjem jakih osnova. Ova metoda je bila povijesno prva, uz pomoć od kojih je prvi Karbenov generiran kao srednji - dichlorkarben (J. Hein 1950). Kada se komuniciraju s teškim bazama hloroform (RKA hloroform je ~ 16), bromoormAl (RCA \u003d 9) i drugi trigolog-a formiraju se anion koji se stabilizira eliminiranjem halogene iona s formiranjem digokarbena. Akcija na hloroformama jakih baza dobiva dichlorkarben:
dichlorkarben
Kao bazu, može se koristiti litiuroganski spojevi u ravnodušnom aprotičnom medijumu. Tada se ispod -100 0 C može fiksirati u formiranju triklometil litijuma kao srednjeg.

Koristeći jake baze kao što su RLI, možete generirati prekriveni iz derivata 1,1-dignalogeneze

Posljednjih godina, za generiranje Digalokarbena umjesto toga n.-Sutilitija se široko koristi kao baza BIS (trimetilsilyl) natrijum amida.
Istovremeno se razlikuje hemijski inertno vođenje [BIS (trimetilsilsil) amide]. BIS (trimetilsilyl) natrijum amid, za razliku od N-butil litijuma, može se odvojiti u inertnoj atmosferi u suvom obliku. U praksi se njena bitna rješenja mogu koristiti češće, što se dugo pohranjuje na sobnoj temperaturi.
Dichlorkarben se takođe može generirati termičkom dekarboksilacijom natrijum-suhih kloroacetata:
Jedna od najpovoljnijih modernih metoda za generiranje dichlorkarbene iz hloroform pod djelovanjem natrijum hidroksida u uvjetima međusobne katalize detaljno će se opisati.
Dichlorkarben se pridružuje alkenima, dajući dihlorocyclopropans. Veza se javlja stereospecifična - konfiguracija početnog alkena sačuvana je u reakcijskom proizvodu - ciklopropane:
 (69)
(69)
tranrence-2-buten tranrence-1,2-dimetil-3,3-
dihlocyclopropan
 (70)
(70)
cIS-2-buten tUŽILAC WHITING - PITANJE:od-1,2-dimetil-3,3-
dihlocyclopropan
 (71)
(71)
7,7-diklorubiciclohept
Pri vraćanju 1,1-dignalikoklopropansa pod djelovanjem litijuma u mpem.-Butyl alkohol, cink u sirćetnu kiselinu ili natrijum u tečnom amoniju, oba halogena atoma zamijenjena su vodikom. Ovo je jedna od općih metoda za proizvodnju ciklopropanskih derivata.
biciklicheptan.
UPR. jedanaest.Dovršite reakciju:


(Z) -3-metil-2-pentene metilenecyclohexane
Odgovoriti

B. Metilen
Metilen se može dobiti razgradnjom dijazometana. Diazomethane je relativno nestabilna supstanca koja se razgrađuje kada je ozračivanje na azotu i metilenu.
 (73)
(73)
diazometan
Metilen: CH 2 sa dijazomettanskim fotolidijom formiran je u manje stabilnom singletnom obliku. Singlet metilen pod reakcijskim uvjetima kao rezultat sudara sa dijazometanskom ili molekulama dušika, brzo gubi energiju i pretvara se u stabilniji triplet metilen.
Za singl Carbenis karakterizira ga sinkroni priključak na dvostruku vezu alkena s potpunim očuvanjem geometrije na dvostrukom obvezniku (reakcija - cikloper spoj). Prilog singletskog oblika karbenijuma dolazi do dvostrukog obveznica, tako strogo stereospecifični.
B. Simmons reakcije-Smith
Efektivno i eksperimentalno, vrlo jednostavna metoda pretvaranja alkena u derivatima ciklopropana zasnovana je na reakciji alkena sa jodistanskim metilenom i cinkama i legurom bakra. Ova reakcija otvorila je 1958. Simmons i Smith i odmah je osvojio široku popularnost u sintezi ciklopropanskih derivata. Aktivna čestica u ovoj reakciji nije Carben : CH 2 i karbenoid - Iodid jodometil Biciklizam Iznch 2 I, formiran interakcijom metilen jodida i cink-bakarnog para.
diodrov idomeometilcinodid
(Pravi Simmons Smith)
 (75)
(75)
Reakcija prolazi kroz sljedeći mehanizam:

Simmons Smith reakcija vrlo je zgodna metoda pretvaranja alkena u ciklopropan.
UPR. 12.Dovršite reakciju:


Odgovoriti
 (76)
(76)
metilenecyclopentan spiroheptan.
 (77)
(77)
styrene ciklopropylbenzene.
 Završiti. Furnitura. Popravke. Instalacija. Izbor. Otvaranje
Završiti. Furnitura. Popravke. Instalacija. Izbor. Otvaranje